题目内容
【题目】硼氢化钠(NaBH4,硼为+3价)为白色粉末,在干燥空气中稳定,在潮湿空气中分解,是常用的还原剂。偏硼酸钠(NaBO2)易溶于水,不溶于乙醇,易水解。目前有多种工艺可制备NaBH4。
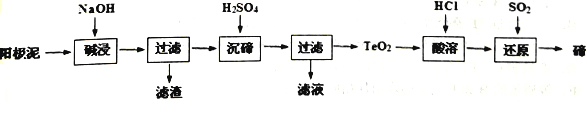
(1)用硼精矿(含有一定量B2O3,及Al2O3、SiO2、Fe2O3等杂质)制取NaBH4的流程如下:

① “溶解”时,B2O3与NaOH反应生成了NaBO2,反应离子方程式为________。
② “除硅铝”步骤加入CaO,而不加入CaCl2的原因有:能将硅、铝以沉淀除去;尽量不带入杂质离子;________。
③ “操作2”是将滤液蒸发、结晶、洗涤,其中洗涤选用的试剂最好是________。
④ “反应1”是MgH2与NaBO2混合得到NaBH4和MgO,其化学方程式为________。
(2)我国孙彦平采用耐腐蚀电极材料,以阳离子交换膜为隔离膜,电解偏硼酸钠的碱溶液,也可以高效制备NaBH4。该工艺阳极产物为________,阴极电极方程式为________。
【答案】 略 略 乙醇 略 O2 略
【解析】本题以硼精矿为原料制备NaBH4的流程为载体,考查流程的分析、离子方程式的书写、盐类水解的应用、基本实验操作、电解原理。硼精矿中加入NaOH溶解,其中B2O3、Al2O3、SiO2分别转化成溶于水的NaBO2、NaAlO2、Na2SiO3进入滤液;滤液中加入CaO将硅铝以沉淀除去;将NaBO2与MgH2反应得到NaBH4和MgO。电解NaBO2的碱溶液制备NaBH4,NaBH4中H元素的化合价为-1价,NaBH4为阴极产物。
(1)①“溶解”时,B2O3与NaOH反应生成NaBO2和H2O,反应的化学方程式为B2O3+2NaOH=2NaBO2+H2O,离子方程式为B2O3+2OH-=2BO2-+H2O。
②根据流程加入CaO将硅铝转化为Na2O·3CaO·Al2O3·nSiO2沉淀而除去;根据题意“NaBO2易水解”,加入CaO使溶液呈碱性,抑制NaBO2的水解,而CaCl2溶液呈中性,不能抑制NaBO2的水解,所以“除硅铝”步骤中加入CaO,而不加入CaCl2。
③“操作2”将滤液蒸发、结晶、洗涤得到NaBO2,根据“NaBO2易溶于水、不溶于乙醇、易水解”,为了减少NaBO2的溶解损失和水解,洗涤选用的试剂最好为乙醇。
④NaBH4中B为+3价,则NaBH4中H为-1价。“反应1”是MgH2与NaBO2混合得到NaBH4和MgO,该反应前后元素的化合价不变,该反应为非氧化还原反应,根据原子守恒,反应的化学方程式为2MgH2+NaBO2=NaBH4+2MgO。
(2)电解NaBO2的碱溶液制备NaBH4,NaBH4中B为+3价,则NaBH4中H为-1价,NaBH4为还原产物,在阴极生成;根据放电顺序,阳极电极反应式为4OH--4e-=O2↑+2H2O,阳极产物为O2;阴极电极反应式为BO2-+8e-+6H2O=BH4-+8OH-。

【题目】下列各组反应(表内物质均为反应物)刚开始时,放出H2的速率最大的是( )
编号 | 金属(粉末状) | 酸的浓度 | 酸的体积 | 反应温度 |
A | 0.1molMg | 6mol/L硝酸 | 10mL | 60℃ |
B | 0.1molMg | 3mol/L盐酸 | 10mL | 60℃ |
C | 0.1molFe | 3mol/L盐酸 | 10mL | 60℃ |
D | 0.1molMg | 3mol/L盐酸 | 10mL | 30℃ |
A.AB.BC.CD.D