��Ŀ����
�ڳ����£�X2(g)��H2��Ӧ����HX��ƽ�ⳣ���������ʾ��������K�ı仯�����ڵ����ʵ���Ũ�ȵ�H2��X2�ķ�Ӧ������˵����ȷ����(����)
| ��ѧ����ʽ | ƽ�ⳣ��K |
F2��H2 2HF 2HF | 6.5��1095 |
Cl2��H2 2HCl 2HCl | 2.6��1033 |
Br2��H2 2HBr 2HBr | 1.9��1019 |
I2��H2 2HI 2HI | 8.7��102 |
A.F2��ת�������
B��X2��H2��Ӧ�ľ��ҳ̶�����
C��X2��H2��Ӧ�ķ�Ӧ�������μ�С
D�������¶ȣ�ƽ�ⳣ��������
A
����

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д����ܱ������д������·�Ӧ��A (g)+3B(g) 2C(g)����H��0��ij�о�С���о���ֻ�ı�ijһ������������Ӧ��Ӱ�죬������ʵ�������������й�ϵͼ��

�����ж�һ���������
| A��ͼ���о�����ѹǿ�Է�Ӧ��Ӱ�죬���ҵ�ѹǿ�ϸ� |
| B��ͼ���о�����ѹǿ�Է�Ӧ��Ӱ�죬�Ҽ�ѹǿ�ϸ� |
| C��ͼ���о������¶ȶԷ�Ӧ��Ӱ�죬�Ҽ��¶Ƚϸ� |
| D��ͼ���о����Dz�ͬ�����Է�Ӧ��Ӱ�죬�Ҽ�ʹ�ô�����Ч�ʽϸ� |
�мס���������ͬ�ĺ����ܱ������������Ϊ0.25 L������ͬ�¶��¾��������淴Ӧ��X2(g)��3Y2(g)  2XY3(g)����H����92.6 kJ��mol��1��ʵ������ʼ��ƽ��ʱ���й����������ʾ��
2XY3(g)����H����92.6 kJ��mol��1��ʵ������ʼ��ƽ��ʱ���й����������ʾ��
| ������� | ��ʼʱ�����ʵ����ʵ���/mol | ƽ��ʱ��ϵ �����ı仯 | ||
| X2 | Y2 | XY3 | ||
| �� | 1 | 3 | 0 | �ų�������23.15 kJ |
| �� | 0.9 | 2.7 | 0.2 | �ų�������Q |
���������������(����)
A�������������Ϊ0.5 L����ƽ��ʱ�ų�������С��23.15 kJ
B���������д�ƽ��ʱ�ų�������Q��23.15 kJ
C�������ס����з�Ӧ��ƽ�ⳣ�����
D��ƽ��ʱ������������XY3�����������Ϊ1/7
ͼ�ס�ͼ�ҷֱ��ʾ��ӦCO2(g)+H2(g) CO(g)+H2O(g) ��H��0 ��t1ʱ�̴ﵽƽ�⣬��t2ʱ����ı�ij�������������仯�����������˵����ȷ����( )
CO(g)+H2O(g) ��H��0 ��t1ʱ�̴ﵽƽ�⣬��t2ʱ����ı�ij�������������仯�����������˵����ȷ����( )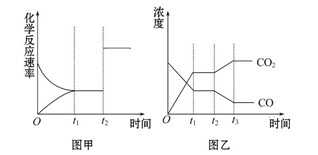
| A��ͼ����t2ʱ�̷����ı������������Ӧ���Ũ�� |
| B��ͼ����t2ʱ�̷����ı����������������ѹǿ |
| C��ͼ����t2ʱ�̷����ı�������������¶� |
| D��ͼ����t2ʱ�̷����ı�������Ǵ���ϵ�з����ˮ���� |
������(Co)������CO���ⷴӦ�Ĵ�����500 Kʱ�д���Ӧ��CO(g)��3H2(g) CH4(g)��H2O(g)����H<0�������й�˵����ȷ����(����)
CH4(g)��H2O(g)����H<0�������й�˵����ȷ����(����)
| A����������Ӧ�ã�����˴����Ĵ����� |
| B����С���������ƽ��������Ӧ�����ƶ���CO��Ũ�ȼ�С |
| C���¶�Խ�ͣ�Խ������CO������ |
| D����ƽ����ϵ�з����H2O(g)�ܼӿ�����Ӧ���� |
һ�������£������Ϊ10 L�Ĺ̶������з�����Ӧ��N2��g����3H2��g�� 2NH3��g������H��0����Ӧ������ͼ��
2NH3��g������H��0����Ӧ������ͼ��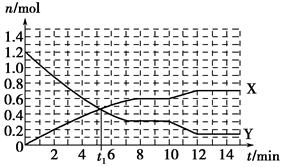
����˵����ȷ���ǣ���������
| A��t1 minʱ�����淴Ӧ������� |
| B��X���߱�ʾNH3�����ʵ�����ʱ��仯�Ĺ�ϵ |
C��0��8 min��H2��ƽ����Ӧ����v��H2����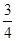 mol��L��1��min��1 mol��L��1��min��1 |
| D��10��12 min�������¶�ʹ��Ӧ���ʼӿ죬ƽ�������ƶ� |
NaHSO3��Һ�ڲ�ͬ�¶��¾��ɱ�����KIO3��������NaHSO3��ȫ���ļ���I2����������I2��������ʱ��������NaHSO3�ķ�Ӧ���ʡ���Ũ�Ⱦ�Ϊ0.020 mol��L��1��NaHSO3��Һ(����������)10.0 mL��KIO3(����)������Һ40.0 mL��ϣ���¼10��55 �����Һ����ʱ�䣬55 ��ʱδ�۲쵽��Һ������ʵ��������ͼ����ͼ�����������жϲ���ȷ����(����)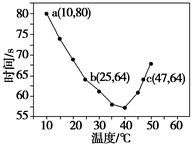
| A��40 ��֮ǰ��40 ��֮����Һ������ʱ�����¶ȵı仯�����෴ |
| B��ͼ��b��c�����Ӧ��NaHSO3��Ӧ������� |
| C��ͼ��a���Ӧ��NaHSO3��Ӧ����Ϊ5.0��10��5 mol��L��1��s��1 |
| D���¶ȸ���40 ��ʱ�����۲���������ʵ���ָʾ�� |
���з�Ӧ�з�����ͼͼ�����( )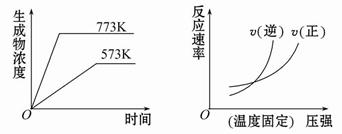
A��N2(g)+3H2(g) 2NH3(g) ��H=��Q1 kJ��mol-1(Q1��0)�� 2NH3(g) ��H=��Q1 kJ��mol-1(Q1��0)�� |
B��2SO3(g) 2SO2(g)+O2(g) ��H=+Q2 kJ��mol-1(Q2��0) 2SO2(g)+O2(g) ��H=+Q2 kJ��mol-1(Q2��0) |
C��4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ��H=��Q3 kJ��mol-1(Q3��0) 4NO(g)+6H2O(g) ��H=��Q3 kJ��mol-1(Q3��0) |
D��H2(g)+CO(g) C(s)+H2O(g) ��H=+Q4 kJ��mol-1(Q4��0) C(s)+H2O(g) ��H=+Q4 kJ��mol-1(Q4��0) |
 pC��g����qD�У�A��C������ɫ���壬�ﵽƽ�������������ȷ���ǣ���������
pC��g����qD�У�A��C������ɫ���壬�ﵽƽ�������������ȷ���ǣ���������