��Ŀ����
����Ŀ������A��B��C��D��E���ֶ�����Ԫ�أ���֪A��B��C��D����Ԫ�صĺ���������֮��Ϊ56����Ԫ�����ڱ��е�λ����ͼ��ʾ��1 mol E�ĵ��ʿ��������ᷴӦ���ܲ���33.6L H2(�ڱ�״����)��E����������A�������Ӻ�����Ӳ�ṹ��ͬ��
A | ||
B | C | D |
�ش��������⣺
��1��д��Ԫ��A����______��Ԫ��B����________��Eԭ�ӵ���ʽ________
��2��C�ļ����ӽṹʾ��ͼΪ_____________
��3��B������A������ȼ�գ���Ӧ������___________��������Ļ�ѧʽΪ___________
��4��A��E�γɵĻ�����ĵ���ʽΪ__________���������ʾ������������ʵķ�����Ӧ����____________������������/����������/���������
��5����D��E�γɵĻ������ˮ��Һ�е����ռ���Һ���������˹����й۲쵽��������_________��д��������DE������ռӦ�Ļ�ѧ��Ӧ����ʽ________��
���𰸡��� P ![]()
 ����ȼ�գ��д������� P2O5
����ȼ�գ��д������� P2O5 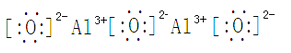 ���������� �ȳ��ְ�ɫ�����������μӣ���ɫ�����ܽ� AlCl3 + 4NaOH == 3NaCl + NaAlO2 + 2H2O
���������� �ȳ��ְ�ɫ�����������μӣ���ɫ�����ܽ� AlCl3 + 4NaOH == 3NaCl + NaAlO2 + 2H2O
��������
��λ��ͼ��֪��A�ڵڶ����ڣ�B��C��D���ڵ������ڣ���C��������Ϊx����A��������Ϊx-8��B��������Ϊx-1��D��������Ϊx+1��A��B��C��D����Ԫ��ԭ�Ӻ����56�����ӣ���x+��x-8��+��x-1��+��x+1��=56�����x=16����AΪO��BΪP��CΪS��DΪCl��1molE���������������ã��ڱ�״�����ܲ�����״����33.6LH2����E�Ļ��ϼ�Ϊy�����ݵ���ת���غ��֪ ymol=![]() ��2=3mol��E����������A�������Ӻ�����Ӳ�ṹ��ȫ��ͬ����EΪAl��Ȼ������Ԫ�ؼ��䵥�ʡ�����������������
��2=3mol��E����������A�������Ӻ�����Ӳ�ṹ��ȫ��ͬ����EΪAl��Ȼ������Ԫ�ؼ��䵥�ʡ�����������������
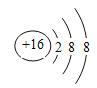
��1�������֪��Ԫ��A����Ϊ����Ԫ��B����ΪP��Eԭ�ӵ�����㺬��3�����ӣ�����ʽ![]() ��
��
��2��CΪ�����ӽṹʾ��ͼΪ ��
��
��3��B������A������ȼ�գ����������������ף���Ӧ�����Ǿ���ȼ�գ��д������̣�������Ļ�ѧʽΪP2O5��
��4��A��E�γɵĻ�����Ϊ������������ʽΪ![]() �����������ᷴӦ��������Ӧ�����ʾ������������ʵķ�����Ӧ�������������
�����������ᷴӦ��������Ӧ�����ʾ������������ʵķ�����Ӧ�������������
��5����D��E�γɵĻ������Ȼ�����ˮ��Һ�е����ռ���Һ������������ƫ�����ƣ��˹����й۲쵽���������ȳ��ְ�ɫ�����������μӣ���ɫ�����ܽ⣬������ռӦ�Ļ�ѧ��Ӧ����ʽAlCl3 + 4NaOH = 3NaCl + NaAlO2 + 2H2O��

 ͬ����ϰ���ϴ�ѧ������ϵ�д�
ͬ����ϰ���ϴ�ѧ������ϵ�д� ͬ����ϰ����ʦ����ѧ������ϵ�д�
ͬ����ϰ����ʦ����ѧ������ϵ�д� ����ϰ�⽭��ϵ�д�
����ϰ�⽭��ϵ�д� ѧ���쳵��������������������ϵ�д�
ѧ���쳵��������������������ϵ�д�����Ŀ��ij����С��ֱ�����ͼ��ʾװ�ö�ԭ��غ͵��ԭ������ʵ��̽����

��ش�
I����ͼ1��ʾװ�ý��е�һ��ʵ�顣
��1���ڱ�֤�缫��Ӧ���������£��������Cu���缫����_________������ĸ��ţ���
A���� | B��ʯī | C���� | D���� |
��2��N��������Ӧ�ĵ缫��ӦʽΪ____________________��
��3��ʵ������У�SO42-_________�����������������������������������������ƶ���
��ֽ���ܹ۲쵽��������___________________��
II����ͼ2��ʾװ�ý��еڶ���ʵ�顣ʵ������У������������������Y������Һ����Ϻ�ɫ��ֹͣʵ�飬���缫���Ա�ϸ�����Һ��Ȼ���塣�������Ϸ��֣����������FeO42-������Һ�г��Ϻ�ɫ��
��4���������У�X������Һ��pH___________������������ ������С�����������������������У�Y�������ĵ缫��ӦΪFe-6e-+8OH-=FeO42-+4H2O ��_______________��
��5������X���ռ���672 mL���壬��Y���ռ���168 mL���壨��������Ϊ��״��ʱ�������������Y�缫�����缫����������________g��
����Ŀ���о�NO2��NO��SO2��CO�ȴ�����Ⱦ����Ĵ���������Ҫ���塣���÷�Ӧ6NO2��g��+8NH3��g��![]() 7N2��g��+12H2O��g���ɴ���NO2��
7N2��g��+12H2O��g���ɴ���NO2��
��1����2L���ܱ������У�2�����ڣ�������Ӧ���������ʵ���������0.25mol����2������v��NH3��=______��
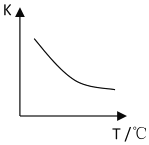
��2���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽK=______����֪�÷�Ӧƽ�ⳣ����K�����¶ȣ�T���Ĺ�ϵ��ͼ��ʾ���������¶ȣ���v����Ӧ______v�淴Ӧ������ڡ�����С�ڡ����ڡ�������Ӧ�ﵽƽ�������С��Ӧ��������������������䣬���������ƽ��ʽ����______����������С�����䡱����
�����Ǵ�����Ⱦ��Σ��֮һ����������SO2���ĺ����ǿ�����������һ����Ҫָ�ꡣij��ȤС��ͬѧ�ռ�ij�ص���ˮ����ʵ�飬ÿ��1h��ͨ��pH�Ʋⶨ��ˮ��Ʒ��pH����õĽ�����±���
�ⶨʱ��/h | 0 | 1 | 2 | 3 | 4 |
��ˮ��Ʒ��pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
��3����д������pH�仯��ԭ��______��
��4�������ʵ���Ũ����ȵ����������Һ����NH4Cl ��NH4HCO3 ��NH4HSO4����������Һ��ˮ�ĵ���̶��ɴ�С��˳����______�����ţ���
��5����BaCl2��Һ��ͨ������SO2���壬û�г������ɣ������μ�һ�����İ�ˮ������BaSO3�������õ���ƽ��ԭ��������������______��
����Ŀ��һ�������£�2SO2(g)��O2(g)![]() 2SO3(g)����Ӧ���̵������仯��ͼ��ʾ����֪1 mol SO2(g)����Ϊ1 mol SO3(g)�ġ�H����99��kJ��mol��1��
2SO3(g)����Ӧ���̵������仯��ͼ��ʾ����֪1 mol SO2(g)����Ϊ1 mol SO3(g)�ġ�H����99��kJ��mol��1��

��1��ͼ�С�H��___________kJ��mol��1������ֵ����
��2��д��SO3(g)�ֽ��SO2(g)��O2(g)���Ȼ�ѧ����ʽ��_____________________��
��3�����������V2O5����ʹͼ��B��___________������ߡ����͡�����
��4���ӻ�ѧ���Ƕȷ�����E��ʾ�����壺______________________________��
��5��ij��ҵ����ʵ���������£�
�¶� | ѹǿ��ͬʱSO2��ת���ʣ�%�� | ||||
1.01��105 Pa | 5.05��105 Pa | 1.01��106 Pa | 5.05��106 Pa | 1.01��107 Pa | |
450�� | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
550�� | 85.6 | 92.9 | 94.9 | 97.7 | 98.3 |
����Ϊ�����˵�������______________________��
��6����֪��S(s)����3 mol SO3(g)���ų�1185 kJ���������������ȼ����Ϊ_____kJ��mol��1��
��7��β��SO2�����ð�ˮ���ճ�ȥ��
��֪25��ʱ��NH3��H2O ��Kb��1.8��10��5��H2SO3��Ka1��1.3��10��2��Ka2��6.2��10��8��
������ˮ��Ũ��Ϊ2.0 mol/L����Һ�е�c(OH��)��___________mol/L��
�ڽ�SO2 ͨ��ð�ˮ�У���c(OH��)����1.0��10��7 mol/Lʱ����Һ�е�c(SO32��)/c(HSO3��)��___________��







