题目内容
【题目】一定条件下,2SO2(g)+O2(g)![]() 2SO3(g),反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的△H=-99 kJ·mol-1。
2SO3(g),反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的△H=-99 kJ·mol-1。
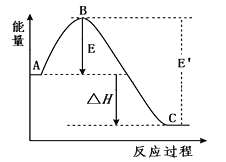
(1)图中△H=___________kJ·mol-1(填数值);
(2)写出SO3(g)分解成SO2(g)和O2(g)的热化学方程式:_____________________。
(3)加入催化剂(V2O5)会使图中B点___________(填“升高”或“降低”)。
(4)从化学键角度分析,E表示的意义:______________________________。
(5)某工业生产实验数据如下:
温度 | 压强不同时SO2的转化率(%) | ||||
1.01×105 Pa | 5.05×105 Pa | 1.01×106 Pa | 5.05×106 Pa | 1.01×107 Pa | |
450℃ | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
550℃ | 85.6 | 92.9 | 94.9 | 97.7 | 98.3 |
你认为最适宜的条件是______________________。
(6)已知由S(s)生成3 mol SO3(g)共放出1185 kJ的热量,单质硫的燃烧热为_____kJ·mol-1。
(7)尾气SO2可以用氨水吸收除去。
已知25℃时,NH3·H2O 的Kb=1.8×10-5,H2SO3:Ka1=1.3×10-2、Ka2=6.2×10-8。
①若氨水的浓度为2.0 mol/L,溶液中的c(OH-)=___________mol/L。
②将SO2 通入该氨水中,当c(OH-)降至1.0×10-7 mol/L时,溶液中的c(SO32-)/c(HSO3-)=___________。
【答案】-198 2SO3(g) ![]() 2SO2(g)+O2(g);ΔH=+198kJ·mol-1 降低 形成化学键释放的热量 450℃,1.01×105Pa 296 6.0×10-3 0.62
2SO2(g)+O2(g);ΔH=+198kJ·mol-1 降低 形成化学键释放的热量 450℃,1.01×105Pa 296 6.0×10-3 0.62
【解析】
根据热化学反应方程式的书写规则及盖斯定律的应用分析解答;根据影响弱电解质的电离平衡的因素与电离平衡的关系分析解答。
(1) 因1mol SO2(g)氧化为1mol SO3的△H=-99kJmol-1,所以2molSO2(g)氧化为2molSO3的△H=-198kJmol-1,则2SO2(g)+O2(g)=2SO3(g)△H=-198KJmol-1;
故答案为:-198;
(2) SO3(g)分解成SO2(g)和O2(g)是2SO2(g)+O2(g)=2SO3(g)△H=-198KJmol-1的逆反应,热反应方程式为:2SO3(g) ![]() 2SO2(g)+O2(g);ΔH=+198kJ·mol-1;
2SO2(g)+O2(g);ΔH=+198kJ·mol-1;
故答案为:2SO3(g) ![]() 2SO2(g)+O2(g);ΔH=+198kJ·mol-1;
2SO2(g)+O2(g);ΔH=+198kJ·mol-1;
(3)因为催化剂改变了反应的历程使活化能E降低,所以B点降低;
故答案为:降低;
(4)从图像可知,E表示的是1molSO2与O2反应生成1molSO3的过程中放出的能量,从化学键的角度分析,即是形成化学键时放出的能量;
故答案为:形成化学键时放出的能量;
(5)当压强是1.01×107 Pa,450℃时,转化率最高,但是压强很高时,耗能太大,且转化率没有比当压强是1.01×105 Pa,450℃时高很多,综合考虑能源消耗等因素,所以我认为最适宜的条件是450℃,1.01×105Pa;
(6)根据题意已知,1molSO2(g)氧化为1molSO3的△H=-99kJmol-1,则①SO2(g)+![]() O2(g)=SO3(g)△H=-99kJmol-1,S(s)生成3 mol SO3(g)共放出1185 kJ的热量,即②S(s)+
O2(g)=SO3(g)△H=-99kJmol-1,S(s)生成3 mol SO3(g)共放出1185 kJ的热量,即②S(s)+![]() O2(g)=SO3(g)△H=--1185 kJmol-1,利用盖斯定律,②-①可得到,S(s)+O2(g)=SO2(g)△H=-296KJmol-1;
O2(g)=SO3(g)△H=--1185 kJmol-1,利用盖斯定律,②-①可得到,S(s)+O2(g)=SO2(g)△H=-296KJmol-1;
故答案为:296;
(7) ①根据NH3H2O![]() NH4++OH-,电离平衡常数可表示为:K=
NH4++OH-,电离平衡常数可表示为:K=![]() 1.8×10-5,由于c(OH-)=c(NH4+)=
1.8×10-5,由于c(OH-)=c(NH4+)=![]() =6.0×10-3mol/L;
=6.0×10-3mol/L;
故答案为:6.0×10-3;
②当c(OH-)降至1.0×10-7 mol/L时,c(H+)=1.0×10-7 mol/L,根据H2SO3的Ka2=6.2×10-8=![]() ,其中已知c(H+),带入计算,可得到
,其中已知c(H+),带入计算,可得到![]() =
=![]() =0.62;
=0.62;
故答案为:0.62。

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案【题目】现有A、B、C、D、E五种短周期元素,已知A、B、C、D四种元素的核内质子数之和为56,在元素周期表中的位置如图所示,1 mol E的单质可与足量酸反应,能产生33.6L H2(在标准状况下);E的阳离子与A的阴离子核外电子层结构相同。
A | ||
B | C | D |
回答下列问题:
(1)写出元素A名称______,元素B符号________,E原子电子式________
(2)C的简单离子结构示意图为_____________
(3)B单质在A单质中燃烧,反应现象是___________,生成物的化学式为___________
(4)A与E形成的化合物的电子式为__________,它的性质决定了它在物质的分类中应属于____________(酸性氧化物/碱性氧化物/两性氧化物)
(5)向D与E形成的化合物的水溶液中滴入烧碱溶液至过量,此过程中观察到的现象是_________,写出化合物DE与过量烧碱反应的化学反应方程式________。