题目内容
【题目】已知外电路中,电子由铜流向a极。有关下图所示的装置分析合理的一项是
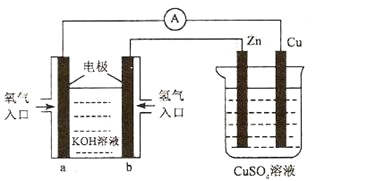
A. 该装置中Cu极为正极
B. 当铜极的质量变化为12 .8g时,a极上消耗的O2在标准状况下的体积为2.24L
C. b极反应的电极反应式为:H2-2e-=2H+
D. 一段时间后锌片质量减少
【答案】B
【解析】
试题已知外电路中,电子由铜流向a极,根据装置图分析,左边为氢氧燃料电池,a为正极,电极反应为:O2+2H2O+4e-=4OH-,b为负极电极反应为H2+2OH--2e-=2H2O,右边装置为电解池,Zn做阴极,电极反应为Cu2++e-=Cu;Cu做阳极,电极反应为Cu-2e-=Cu2+;A、分析判断,铜为电解池中的阳极,A错误;B、当铜极的质量变化为12.8g时物质的量为0.2ml,依据电子守恒和电极反应可知,O2+2H2O+4e-=4OH-,Cu-2e-=Cu2+;2Cu~O2,a极上消耗的O2在物质的量为0.1mol在标准状况下的体积为2.24L,B正确;C、锌做电解池的阴极,质量不变,C错误;D、b电极是氢气失电子发生氧化反应,在碱性溶液中生成水,电极反应为:H2+2OH--2e-=2H2O,D错误;所以选B.

练习册系列答案
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案
相关题目