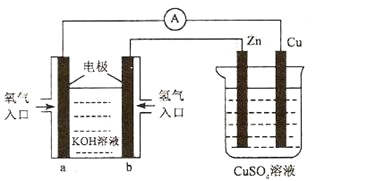
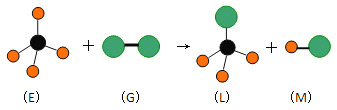
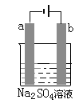
��Ŀ����
����Ŀ����Դ�������������ᷢչ�Ļ������о���ѧ��Ӧ�е������仯�������ڸ��õ����û�ѧ��ӦΪ�������������
(1)��֪���������(���� C8H18��ʾ)��ȼ�յ��Ȼ�ѧ����ʽ��
CH4(g)+2O2(g)�TCO2(g)+2H2O(l)��H=��890kJ/mol��
C8H18(l)+![]() O2(g)�T8CO2(g)+9H2O(l)��H=��5472kJ/mol��
O2(g)�T8CO2(g)+9H2O(l)��H=��5472kJ/mol��
��������ļ��������ȼ�գ������������Ƚ϶����___________(��������������������)
(2)SiH4��һ����ɫ���壬���������ܷ�����ը����ȼ������ SiO2��Һ̬ H2O����֪������ 2gSiH4��ȼ�ų����� 89.2kJ��SiH4��ȼ���Ȼ�ѧ����ʽΪ____________________��
(3)1molH2(g)��1mol Cl2(g)��һ�������·�Ӧ����2 mol HCl(g)���ų�184.5kJ����������֪����1molH2(g)�е�H-H��1mol Cl2(g)�е�Cl-Cl�ֱ���Ҫ����436.4kJ��242.7kJ����������1mol HCl�����еĻ�ѧ���γ�ʱ�ͷ�_________kJ��������
���𰸡����� SiH4(g)+2O2(g)=SiO2(g)+2H2O(l) ��H= -1427.2kJ/mol 431.8
��������
(1)����ȼ��������1g���ֱ������߲��������Ķ��٣�Ȼ����бȽϣ�
(2)���ݼ������������1mol����ȼ�շų�����������ϻ�ѧ����ʽ��д�Ȼ�ѧ����ʽ��ע�����ʵľۼ�״̬�ͷ�Ӧ�ȵĵ�λ�����⣻
(3)����Ϣ��֪������H2(g)+Cl2(g)=2HCl(g) ��H=-184.5kJ/mol���ʱ���ڶ��ѻ�ѧ�����յ�������ȥ�ɼ��ͷŵ��������Դ������
(1)�ɼ��顢����ȼ�յ��Ȼ�ѧ����ʽCH4(g)+2O2(g)�TCO2(g)+2H2O(l) ��H=��890kJ/mol��C8H18(l)+![]() O2(g)�T8CO2(g)+9H2O(l) ��H=��5472kJ/mol����֪1g����ȼ�ղ���������ΪQ1=
O2(g)�T8CO2(g)+9H2O(l) ��H=��5472kJ/mol����֪1g����ȼ�ղ���������ΪQ1=![]() =55.625kJ/g��1g����ȼ�շų�����Q2=
=55.625kJ/g��1g����ȼ�շų�����Q2=![]() =48kJ/g���ɼ��������������ͺͼ���ȼ�գ�������������������Ͷࣻ
=48kJ/g���ɼ��������������ͺͼ���ȼ�գ�������������������Ͷࣻ
(2)2g SiH4�����ʵ���n(SiH4)=![]() =
=![]() mol��1molSiH4ȼ�շų�������Ϊ��89.2kJ��16=1427.2kJ����Ӧ���Ȼ�ѧ����ʽΪ��SiH4(g)+2O2(g)=SiO2(g)+2H2O(l) ��H=-1427.2kJ/mol��
mol��1molSiH4ȼ�շų�������Ϊ��89.2kJ��16=1427.2kJ����Ӧ���Ȼ�ѧ����ʽΪ��SiH4(g)+2O2(g)=SiO2(g)+2H2O(l) ��H=-1427.2kJ/mol��
(3)��1molHCl�����еĻ�ѧ���γ�ʱ�ͷ�����ΪxKJ������Ϣ��֪�Ȼ�ѧ����ʽΪH2(g)+Cl2(g)=2HCl(g) ��H=-184.5kJ/mol����436kJ/mol+242.7kJ/mol-2xkJ/mol=-184.5kJ/mol�����x=431.8��

 �����ҵ��ٿ���������������ϵ�д�
�����ҵ��ٿ���������������ϵ�д�����Ŀ���±�ΪԪ�����ڱ���һ���֣������Ԫ�آ٣����ڱ��е�λ�ã��ش����⣺
�� ���� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0 |
1 | �� | |||||||
2 | �� | �� | �� | |||||
3 | �� | �� | �� | �� | �� |
��1���������ڰ뵼����ϵ�Ԫ�������ڱ��е�λ����__________________��
��2���ۡ��ܡ����ԭ�Ӱ뾶��С��___________________����Ԫ�ط����ش𣩡�
��3���ݡ��ޡ��ߵ�����������Ӧ��ˮ���������ǿ����__________������ѧʽ�ش𣩡�
��4���ڡ��ۡ��ܵ���̬�⻯��ȶ�����ǿ����__________�����ṹʽ�ش�
��5���ں͢۰�ԭ����1:2�γɵĻ����������ʽΪ____________���þ��������Ĺ����п�
��������������Ϊ_______________________��
��6���ۺ͢��γɵĻ���������_______________������ӻ�������ۻ���������þ�������________���壨����ӡ��������ӡ�����ԭ�ӡ�����
��7��Ԫ�آݡ��ߵ�����������ˮ���ﻥ�෴Ӧ�Ļ�ѧ����ʽΪ��___________________��