��Ŀ����
����Ŀ���ߴ����������й㷺����;��ij�о�С��������������ȡ�ߴ�����������
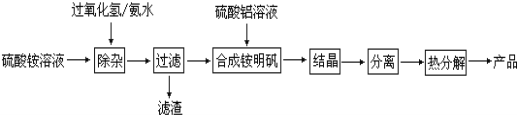
������������ͼ��գ�
��1�������ӡ��������ȼ�����������ַ�Ӧ�����ð�ˮ������Һ��pH��ʹ�������Һ�е�����Fe2+����ΪFe3+����һ��ת��ΪFe(OH)3�Ӷ���ȥFe2+����Fe2+��������������ΪFe3+�����ӷ���ʽΪ: ��
��2��������������Һʱ�����������ữ���ữ��Ŀ���� ��
��3�������롱������������ (����ĸ����)��
A������ B����Һ C������
��4�����������Ļ�ѧʽΪNH4Al(SO4)212H2O����������� (����������)��0.1mol/L�������ˮ��Һ�У�Ũ������������ ��
��5���ȷֽ��з������·�Ӧ6NH4Al(SO4)2 = 3Al2O3 + 2NH3 ��+ 2N2 ��+ 6SO2 ��+ 6SO3 ��+ 9H2O��������1mol Al2O3ʱת�Ƶ������ʵ���Ϊ mol��
��6������0.1mol�����ϡ��Һ����μ��뺬0.3mol Ba(OH)2��ϡ��Һ����Ӧ�������ӷ���ʽΪ: ��
���𰸡���1��2Fe2+ +H2O2 +2H+=2Fe3++2H2O ��2������Al3+ˮ��(���ֹˮ�ⲻ����) ��3��C
��4�������� SO42- ��5�� 4 ��6�� NH4++Al3++2SO42-+2Ba2++5OH- =NH3��H2O+AlO2-+2BaSO4��+2H2O
��������
�����������1���������Ӿ��л�ԭ����˫��ˮ����ǿ����������������Һ�����������ӱ������������������˷�Ӧ�����ӷ�Ӧ����ʽΪ2Fe2+ +H2O2 +2H+=2Fe3++2H2O��
��2����������������Һ���ܹ�����ˮ�������������������Լ��������ữ�������������ӵ�ˮ�⣻
��3��ͨ�����ˣ����������������Һ�з��룬����C��ȷ��
��4�����������Ļ�ѧʽΪNH4Al(SO4)212H2O���������0.1mol/L�������ˮ��Һ�У�δˮ��ǰ��c(Al3+)=c(NH4+)=0.1mol/L������笠��������Ӿ�ˮ�⣬ˮ����ˮ�����������������ˮ���Ũ�Ⱦ�С��0.1mol/L��c(SO42-)=0.2mol/L����Һ��������ΪSO42-��
��5������Ӧ6NH4Al(SO4)2 = 3Al2O3 + 2NH3 ��+ 2N2 ��+ 6SO2 ��+ 6SO3 ��+ 9H2O��N2���������ÿ����2molN2ת��12mol���ӣ�ͬʱ�õ�3molAl2O3����������1mol Al2O3ʱת�Ƶ������ʵ���Ϊ12mol��3=4mol��
��6������0.1mol�����ϡ��Һ����μ��뺬0.3mol Ba(OH)2��ϡ��Һ��������Ӧ�������ӷ���ʽΪ NH4++Al3++2SO42-+2Ba2++5OH- =NH3��H2O+AlO2-+2BaSO4��+2H2O��