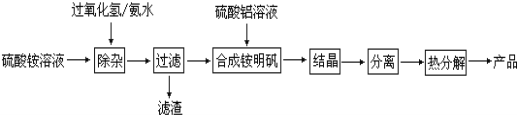
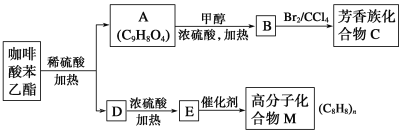
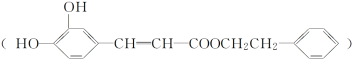��Ŀ����
����Ŀ��A��B��C��D��E����ѧ��ѧ�������ʣ� X��Y��Z��M��N��W��H��K�dz��������X��B��C�Ļ��ϲ������֮��������ת����ϵ����Ӧ��Ͳ����е�H2O����ȥ����


��1��Y�ĵ���ʽΪ ������C���ʵ�Ԫ�������ڱ���λ��
��2����Ӧ�������ӷ���ʽΪ ��Ӧ�������ӷ���ʽΪ
��3��ij������B��Ư�ۡ�
��д����Ư�۵Ļ�ѧ����ʽ
��Ϊ�ⶨ�ù����Ƶõ�Ư������Ч�ɷֵĺ�����ijС�����������ʵ�飺��ȡƯ��2.0g����ĥ���ܽ⣬������250mL��Һ��ȡ��25.00mL���뵽��ƿ�У��ټ��������KI��Һ��������������ʱ���������ӷ���ʽΪ�� ���á�����ȫ��Ӧ����0.1mol��L-1��Na2S2O3��Һ������Һ�ζ���Ӧ���ɵĵ⣬��֪��ӦʽΪ��2Na2S2O3+I2=Na2S4O6+2NaI������ȥNa2S2O3��Һ20.00mL�����Ư������Ч�ɷ�����������Ϊ ��������С�������λ����
���𰸡�(1)![]() ���������ڵ�VIIA�壻
���������ڵ�VIIA�壻
�� 2Cl-+2 H2O ![]() 2OH��+Cl2�� + H2����2Al��2OH��+2 H2O��2AlO
2OH��+Cl2�� + H2����2Al��2OH��+2 H2O��2AlO![]() �� 3H2����
�� 3H2����
��3����2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O��
��ClO��+2I��+2H+=I2+Cl��+H2O ������д������CaSO4�����֣���35.75% ��
��������
�������������������3����ȡƯ�����������������������Ƶķ�Ӧ��X��B��C�Ļ���������XΪNaCl��A��CΪ����������AΪH2��CΪCl2��YΪNaOH��NaOH��D��Ӧ����A����DΪAl��WΪHCl��ZΪNaAlO2��KΪAlCl3��MΪAl(OH)3��W��E��Ӧ����H2����EΪ������HΪ�����Ȼ�����H��������Ӧ�����HΪ��۽�������Ϊ����(1)NaOH�ĵ���ʽΪ��![]() ��Cl��17��Ԫ����λ�ڵ������ڵ�VIIA������2����Ӧ���ǵ�ⱥ��ʳ��ˮ�����ӷ�Ӧ����ʽΪ��2Cl�� �� 2H2O
��Cl��17��Ԫ����λ�ڵ������ڵ�VIIA������2����Ӧ���ǵ�ⱥ��ʳ��ˮ�����ӷ�Ӧ����ʽΪ��2Cl�� �� 2H2O![]() Cl2�� �� H2�� �� 2OH������Ӧ������2Al �� 2OH�� �� 2H2O = 2AlO2�� �� 3H2����(3)��Cl2 �� 2Ca(OH)2 = CaCl2 �� Ca(ClO)2 �� H2O��������Ca(ClO)2������������I��������I2�����ݻ��ϼ�������������ƽ��ClO�� �� 2I�� �� 2H �� = I2 �� Cl�� �� H2O��������ϵʽ��ClO�� ��I2��2Na2S2O3��n(ClO��) = 20 �� 10��3 �� 0.1/2mol = 1 �� 10��3mol��Ư�۵���Ч�ɷ���Ca(ClO)2����Ca(ClO)2������������1 �� 10��3 �� 143 �� 250/(25 �� 2)g = 0.715g������������Ϊ0.715/2 �� 100% = 35.75%��
Cl2�� �� H2�� �� 2OH������Ӧ������2Al �� 2OH�� �� 2H2O = 2AlO2�� �� 3H2����(3)��Cl2 �� 2Ca(OH)2 = CaCl2 �� Ca(ClO)2 �� H2O��������Ca(ClO)2������������I��������I2�����ݻ��ϼ�������������ƽ��ClO�� �� 2I�� �� 2H �� = I2 �� Cl�� �� H2O��������ϵʽ��ClO�� ��I2��2Na2S2O3��n(ClO��) = 20 �� 10��3 �� 0.1/2mol = 1 �� 10��3mol��Ư�۵���Ч�ɷ���Ca(ClO)2����Ca(ClO)2������������1 �� 10��3 �� 143 �� 250/(25 �� 2)g = 0.715g������������Ϊ0.715/2 �� 100% = 35.75%��

����Ŀ����ͼ��ʵ����������������װ�á�
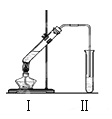
��1������ǰ��ͨ����Ҫ���Թܢ��м������Ƭ��Ŀ���� ��
��2��Ϊ��֤��Ũ��������ã�ijͬѧ����������4��
ʵ�飬ʵ���¼�����
ʵ���� | �Թܢ����Լ� | �Թܢ����Լ� | �л�����/cm |
A | 3mL�Ҵ���2mL���ᡢ1mL18molL��1Ũ���� | ����Na2CO3��Һ | 5.0 |
B | 3mL�Ҵ���2mL���� | ����Na2CO3��Һ | 0.1 |
C | 3mL�Ҵ���2mL���ᡢ6mL3molL��1���� | ����Na2CO3��Һ | 1.2 |
D | 3mL�Ҵ���2mL���ᡢ6mL6molL��1���� | ����Na2CO3��Һ | 1.2 |
��Ϊ���õ��ⶨ����������Ԥ����Na2CO3��Һ�еμ�1�� ��Һ��ÿ��ʵ�������ɹ۲쵽�Թܢ��е������� ��
�ڷ���ʵ��A��B��C�����ݣ����Եó�Ũ�����ڷ�Ӧ�е������� �� ��ʵ��D��ʵ��C���գ������ܵó��Ľ����� ��
��3������Na2CO3��Һ��������____________________��___________��