题目内容
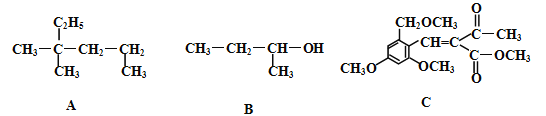
【题目】X、Y、Z、R、Q、M是六种短周期元素,原子序数依次增大。X是原子半径最小的元素,Y的气态氢化物能使湿润的红色石蕊试纸变蓝,Z为地壳中含量最多的元素,R与X同主族;Y、R、Q最外层电子数之和为8,M的单质黄绿色有害气体。请回答下列问题:
(1)R在元素周期表中的位置为___________。
(2)Z、Q、M简单离子半径由大到小的顺序为(写元素离子符号)___________。
(3)X、Y、Z三种元素形成盐类化合物的水溶液呈酸性的原因:(用离子方程式表示)________________。
溶液中所含离子浓度由大到小的顺序为________________。
(4)YX4M的电子式为___________,Q3Y2与水可剧烈反应,产生沉淀与气体,反应的化学方程式为
____________________。
(5)X、Z两元素形成的原子个数比为1:1的化合物中含有的化学键类型为_______________________。
(6)M的单质与R的最高价氧化物对应的水化物反应的离子方程式为_____________________。
【答案】(1)第三周期IA族;
(2)Cl->O2->Mg2+;
(3)NH4++H2O=NH3·H2O+H+;c(NO3-)>c(NH4+)>c(H+)>c(OH-);
(4)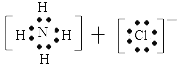 ;Mg3N2+6H2O=3Mg(OH)2+2NH3↑;
;Mg3N2+6H2O=3Mg(OH)2+2NH3↑;
(5)共价键;
(6)Cl2+2OH-=ClO-+Cl-+H2O
【解析】试题分析:X、Y、Z、R、Q、M是六种短周期元素,原子序数依次增大。X是原子半径最小的元素,则X
为H,Y的气态氢化物能使湿润的红色石蕊试纸变蓝为N,Z为地壳中含量最多的元素为O,R与X同
主族,所以R为Na;Y、R、Q最外层电子数之和为8,则Q为Mg,M的单质黄绿色有害气体,则M
为Cl。
(1)钠元素在周期表中的位置是:第三周期、第IIIA族;
(2)Cl-有三个电子层,半径最大,O2-与Mg2-二种离子电子层结构相同,核电荷数越大,半径越小,所以顺序为:Cl->O2->Mg2-
(3)H、N、O三种元素形成盐类化合物为NH4NO3溶液呈酸性,其原因:NH4++H2O=NH3·H2O+H+,溶液中所含离子溶液由大到小的顺序为:c(NO3-)>c(NH4+) >c(H+) >c(OH-);
(4)H、N、Cl形成的化合物为NH4Cl,其电子式为: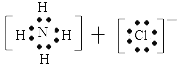 ;Mg3N2易水解生成Mg(OH)2和NH3。反应方程式为:Mg3N2+6H2O=3Mg(OH)2+2NH3↑
;Mg3N2易水解生成Mg(OH)2和NH3。反应方程式为:Mg3N2+6H2O=3Mg(OH)2+2NH3↑
(5)在过氧化氢中有共价键;
(6)Cl2与NaOH反应的离子方程式为:Cl2+2OH-=ClO-+Cl-+H2O。

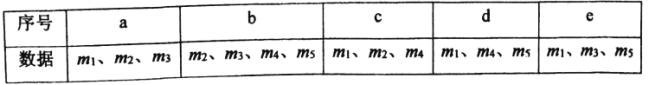
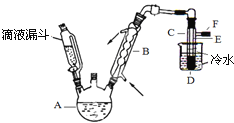
【题目】下图是实验室用乙醇、硫酸、溴化钠混合反应来制备溴乙烷的装置。反应需要加热,图中省去了加热装置。乙醇、溴乙烷、溴的有关性状参数见下表。
乙醇 | 溴乙烷 | 溴 | |
状态 | 无色液体 | 无色液体 | 深红棕色液体 |
密度/g.cm-3 | 0.79 | 1.44 | 3.1 |
沸点/℃ | 78.5 | 38.4 | 59 |
水溶性 | 易溶 | 难溶 | 微溶 |
(1)加热A中三种反应物的混合物时,发生反应的化学方程式为: 。
(2)若选用较浓的硫酸作为反应物,得到的产品则会呈棕黄色,这说明反应过程中有 生成。为去除颜色,最好选择下列的 溶液来洗涤产品。
A.四氯化碳 B.硫酸钠 C.碘化亚铁 D.亚硫酸钠
产品选择上述溶液洗涤后,还需再用蒸馏水洗涤一次。洗涤液与产品分离的方法是 (填方法名称)。
(3)装置中,B和D两部分的作用分别是:B ;D 。