题目内容
【题目】二甲醚作为燃料电池的原料,可通过以下途径制取:
I.2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(g) ΔH
CH3OCH3(g)+H2O(g) ΔH
II.2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) ΔH
CH3OCH3(g)+3H2O(g) ΔH
(1)已知:①CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH1=-41.0kJ·mol-1
CO2(g)+H2(g) ΔH1=-41.0kJ·mol-1
②CO2(g)+3H2(g)![]() CH3OH(g)+ H2O(g) ΔH2=-49.0kJ·mol-1
CH3OH(g)+ H2O(g) ΔH2=-49.0kJ·mol-1
③CH3OCH3(g)+ H2O(g)![]() 2CH3OH(g) ΔH3=+23.5kJ·mol-1
2CH3OH(g) ΔH3=+23.5kJ·mol-1
则反应I的ΔH=_______kJ·mol-1
(2)在10L恒容密闭容器中,均充入4molCO2和7molH2,分别以铱(Ir)和铈(Ce)作催化剂,通过反应II制二甲醚,反应进行相同的时间后测得的CO2的转化率α(CO2)随反应温度的变化情况如图1所示。
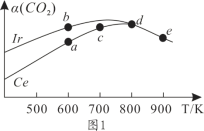
①根据图1,下列说法不正确的是________。
A.反应II的ΔH<0,ΔS>0
B.600K时,H2的速率:v(b)正>v(a)逆
C.分别用Ir、Ce作催化剂时,Ce使反应II的活化能降低更多
D.从状态d到e,α(CO2)减小的原因可能是温度升高平衡逆向移动
②状态e(900K)时,α(CO2)=50%,则此时的平衡常数K=______(保留3位有效数字)。
(3)写出二甲醚碱性(电解质溶液为KOH溶液)燃料电池的负极电极反应式____________________________。
【答案】—203.5 A、C 6.75×104 CH3OCH3 +16OH——12e—=2CO32-+11H2O
【解析】
(1)根据已知反应的反应热和盖斯定律,①×2+②×2— ③ 计算可得ΔH;
(2)①A.由图中信息可知,当温度高于800K时,CO2转化率α(CO2)随反应温度升高而减小,说明该反应为放热反应,ΔH>0,同时该反应气体体积减小,ΔS<0;
B.由图可知,b点CO2转化率α(CO2)大于a点,生成物浓度b点大于a点,故v(b)逆>v(a)逆,由于b点平衡正向进行,v(b)正>v(b)逆,所以v(b)正>v(a)逆;
C.由图中信息可知,当温度为400K![]() 800K时,反应进行相同时间后测得Ir作催化剂的CO2转化率α(CO2)较高,说明Ir的催化效率更高,所以,用Ir、Ce作催化剂时,反应的活化能降低更多的是Ir;
800K时,反应进行相同时间后测得Ir作催化剂的CO2转化率α(CO2)较高,说明Ir的催化效率更高,所以,用Ir、Ce作催化剂时,反应的活化能降低更多的是Ir;
D.状态d、e都是平衡状态,从d到e,该反应为放热反应,升温平衡逆向移动,α(CO2)减小。
②列出三行式,根据二氧化碳平衡转化率,求出平衡时各组份的浓度,再根据平衡常数计算式计算;
(3)根据电池反应式可知,CH3OCH3在反应中被氧化,O2被还原,CH3OCH3在负极上反应。又因为是碱性溶液不可能有H+参加或生成,根据电子守恒、电荷守恒和原子守恒书写负极反应式。
(1)已知:①CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH1=-41.0kJ·mol-1
CO2(g)+H2(g) ΔH1=-41.0kJ·mol-1
②CO2(g)+3H2(g)![]() CH3OH(g)+ H2O(g) ΔH2=-49.0kJ·mol-1
CH3OH(g)+ H2O(g) ΔH2=-49.0kJ·mol-1
③CH3OCH3(g)+ H2O(g)![]() 2CH3OH(g) ΔH3=+23.5kJ·mol-1
2CH3OH(g) ΔH3=+23.5kJ·mol-1
根据盖斯定律,①×2+②×2— ③ 得ΔH=(-41.0 kJ·mol-1)×2+(-49.0kJ·mol-1)×2-(+23.5kJ·mol-1)= -203.5kJ·mol-1
故答案为:—203.5;
(2)①A.由图中信息可知,当温度高于800K时,CO2转化率α(CO2)随反应温度升高而减小,说明该反应为放热反应,ΔH>0,同时该反应气体体积减小,ΔS<0,故A错误;
B.由图可知,b点CO2转化率α(CO2)大于a点,生成物浓度b点大于a点,故v(b)逆>v(a)逆,由于b点平衡正向进行,v(b)正>v(b)逆,所以v(b)正>v(a)逆,故B正确;
C.由图中信息可知,当温度为400K![]() 800K时,反应进行相同时间后测得Ir作催化剂的CO2转化率α(CO2)较高,说明Ir的催化效率更高,所以,用Ir、Ce作催化剂时,反应的活化能降低更多的是Ir,故C错误;
800K时,反应进行相同时间后测得Ir作催化剂的CO2转化率α(CO2)较高,说明Ir的催化效率更高,所以,用Ir、Ce作催化剂时,反应的活化能降低更多的是Ir,故C错误;
D.状态d、e都是平衡状态,从d到e,该反应为放热反应,升温平衡逆向移动,α(CO2)减小,故D正确。
故答案选AC;
②列出三行式,
2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
起始(mol) 4 7 0 0
转化(mol)4×50%=2 6 1 3
平衡(mol) 2 1 1 3
容器容积为10L,则CO2、H2、CH3OCH3、H2O的平衡浓度分别为0.2mol/L、0.1mol/L、0.1mol/L、0.3mol/L,
此时的平衡常数K=![]() =6.75×104。
=6.75×104。
故答案为:6.75×104;
(3)根据电池反应式可知,CH3OCH3在反应中被氧化,O2被还原,CH3OCH3在负极上反应,O2在正极上反应。又因为是碱性溶液不可能有H+参加或生成,故负极反应式为CH3OCH3 +16OH——12e—=2CO32-+11H2O,
故答案为:CH3OCH3 +16OH——12e—=2CO32-+11H2O;