题目内容
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)==Zn(OH)2(s)+Mn2O3(s) 下列说法错误的是
| A.电池工作时,电子由正极通过外电路流向负极 |
| B.电池工作时,锌失去电子 |
| C.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e—=Mn2O3(s)+2OH—(aq) |
| D.外电路中每通过0.2mol e-,锌的质量理论上减小6.5g |
A
解析试题分析:A.电池工作时,电子由负极通过外电路流向正极,错误; B.电池工作时,锌作为负极失去电子,发生氧化反应,正确;C.由电池工作的总方程式可知:电池正极的电极反应式为:2MnO2(s)+ H2O(1) +2e—=Mn2O3(s)+2OH—(aq),正确;D.外电路中每通过0.2mol e-,由于Zn是+2价的金属,所以反应消耗Zn的物质的量是0.1mol,锌的质量理论上减小6.5g。正确。
考点:考查碱性电池的工作原理的知识。

练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案
相关题目
结合下图判断,下列叙述正确的是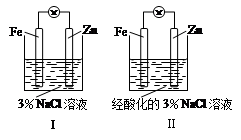
| A.Ⅰ和Ⅱ中正极均被保护 |
| B.Ⅰ和Ⅱ中负极反应均是:Fe-2e-===Fe2+ |
| C.Ⅰ正极反应是:O2 + 2H2O + 4e-===4OH- |
| D.Ⅰ和Ⅱ中分别加入少量KSCN溶液,溶液均变红 |
把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池。对该电池的描述合理的是①溶液中硫酸的物质的量浓度保持不变;②Cu极上有气泡产生,发生还原反应;③Cu为负极,Zn为正极;④原电池在工作时电子由负极通过溶液流向正极;⑤该装置将化学能转变为电能( )
| A.④⑤ | B.③⑤ | C.①② | D.②⑤ |
下图为一原电池的结构示意图,下列说法中,错误的是 
| A.Cu电极为正电极 |
| B.原电池工作时,电子从Zn电极流出 |
| C.原电池工作时的总反应为:Zn+Cu2+=Zn2++Cu |
| D.盐桥(琼脂-饱和KCl溶液)中的K+移向ZnSO4溶液 |
对于锌、铜和稀硫酸组成的原电池(如下图),下列有关说法错误的是
| A.溶液中H+向负极移动 | B.电子由Zn经外电路流向Cu |
| C.Zn电极反应:Zn-2e-=Zn2+ | D.Cu是正极 |
用惰性电极电解下列足量的溶液,一段时间后,再加入一定量的另一物质(括号内)后,溶液能与原来溶液浓度一样的是 ( )
| A.CuCl2(CuCl2溶液) | B.AgNO3(Ag2O) | C.NaCl(HCl溶液) | D.CuSO4(Cu(OH)2) |
我们生活中离不开各种各样的电池,下列关于电池的说法错误的是( )
| A.用后不能再生的电池称为一次电池,如锌锰干电池(电解质溶液中含氯化铵等) |
| B.放电后通过充电可反复使用的电池称为二次电池,如镍镉电池、铅蓄电池等 |
| C.手机、电脑、数码相机中的可充电电池使用寿命长,对环境无害,不用进行回收 |
| D.目前我国生产的无汞干电池,对环境和人体健康没有明显危害,可以不进行特殊处理,和普通垃圾混放 |
下列关于写图所示原电池的叙述中,正确的是
| A.质量减轻的一极是铜极 |
| B.负极反应为Fe—2e→ Fe2+ |
| C.该装置将电能转变为化学能 |
| D.电流由负极经导线流向正极 |
