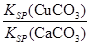题目内容
结合下图判断,下列叙述正确的是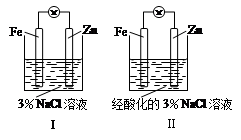
| A.Ⅰ和Ⅱ中正极均被保护 |
| B.Ⅰ和Ⅱ中负极反应均是:Fe-2e-===Fe2+ |
| C.Ⅰ正极反应是:O2 + 2H2O + 4e-===4OH- |
| D.Ⅰ和Ⅱ中分别加入少量KSCN溶液,溶液均变红 |
AC
解析试题分析:锌比铁活泼,装置I中锌做负极,铁做正极,但由于电解质溶液是氯化钠,不能自发进行氧化还原反应,因此不能形成原电池,而是发生锌的吸氧腐蚀,正反应速率是O2 + 2H2O + 4e-=== 4OH-
,因此正极铁被保护,因此A.C选项是正确的。B选项是错误的
装置Ⅱ,锌比铁活泼,因此锌做负极,铁做正极,负极发生的反应是Fe-2e-=== Fe2+,正极发生的是氢离子得到电子生成氢气,铁不参与反应,溶液中无三价的铁离子,因此在电解质溶液中加入硫氰化钾,不能看到溶液变红的现象,因此D选项是错误的
考点:考查原电池性质的相关知识点

滴定实验是化学学科中重要的定量实验。
请回答下列问题:
(1)酸碱中和滴定——用标准盐酸滴定未知浓度的NaOH溶液。
①下列操作造成测定结果偏高的是 (填选项字母)
A.滴定终点读数时,俯视滴定管刻度,其他操作正确。
B.盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗
C.酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗
D.滴定前,滴定管尖嘴有气泡,滴定后气泡消失
②该学生的实验操作如下:
A、用碱式滴定管取稀NaOH 25.00mL,注入锥形瓶中,加入甲基橙做指示剂。
B、用待测定的溶液润洗碱式滴定管。
C、用蒸馏水洗干净滴定管。
D、取下酸式滴定管用标准的HCl溶液润洗后,将标准液注入滴定管刻度“0”以上2~3cm处,再把滴定管固定好,调节液面至刻度“0”或“0”刻度以下。
E、检查滴定管是否漏水。
F、另取锥形瓶,再重复操作一次。
G、把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
a. 滴定操作的正确顺序是(用序号填写)___________________________ 。
b. 在G操作中如何确定终点? __________________________ ____ 。
c. 若换酚酞做指示剂,如何确定终点? _________________________ ____ 。
(2)氧化还原滴定—取草酸溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1mol·L-1的高锰酸钾溶液滴定,发生的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O。表格中记录了实验数据:
| 滴定次数 | 待测液体积 (mL)[来 | 标准KMnO4溶液体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 3.00 | 23.00 |
| 第三次 | 25.00 | 4.00 | 24.10 |
①滴定时,KMnO4溶液应装在 (“酸”或“碱”)式滴定管中,滴定终点时滴定现象是 。
②该草酸溶液的物质的量浓度为_____________。
(3)沉淀滴定――滴定剂和被滴定物的生成物比滴定剂与指示剂的生成物更难溶。
参考下表中的数据,若用AgNO3滴定NaSCN溶液,可选用的指示剂是 (填选项字母)。
| 难溶物 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
| 颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
| Ksp | 1.77×10-10 | 5.35×10-13 | 1.21×10-16 | 1.12×10-12 | 1.0×10-12 |
A.NaCl B.NaBr C.NaCN D.Na2CrO4
Ba(NO3)2可用于生产绿色烟花、绿色信号弹、炸药等。某生产BaCO3、BaSO4的化工厂生产中排出大量的钡泥[主要含有BaCO3、BaSO3、Ba(FeO2)2等],该厂利用钡泥制取Ba(NO3)2晶体(不含结晶水),其部分工艺流程如下:
已知: ①Fe3+和Fe2+以氢氧化物形式沉淀完全时,溶液的pH分别为3.2和9.7;
②Ksp(BaSO4)=1.1×10-10,Ksp(BaCO3)=5.1×10-9。
(1)该厂生产的BaCO3因含有少量BaSO4而不纯,提纯的方法是:将产品加入足量的饱和Na2CO3溶液中,充分搅拌,过滤,洗涤。用离子方程式说明提纯原理: 。
(2)酸溶时,Ba(FeO2)2与HNO3反应生成两种硝酸盐,化学方程式为 。
(3)该厂结合本厂实际,选用的X为 (填序号),中和I使溶液中的 (填离子符号)的浓度减小。
| A.BaCl2 | B.Ba(OH)2 | C.Ba(NO3)2 | D.BaCO3 |
(5)测定所得Ba(NO3)2晶体的纯度:准确称取m1g晶体溶于蒸馏水,加入足量的硫酸,充分反应后,过滤、洗涤、干燥,称量其质量为m2g,则该晶体纯度的计算表达式为 。(已知Ba(NO3)2、BaSO4的式量分别为261、233)
如图所示装置中,a?b都是惰性电极,通电一段时间后(电解液足量),a极附近溶液显红色?下列说法正确的是
| A.a是负极,b是正极 |
| B.CuSO4溶液的pH逐渐减小 |
C.铜电极上的反应式为 |
| D.向NaCl溶液中加入一定量的盐酸,能使溶液与原来溶液完全一样 |
下列金属防腐的措施中,使用外加电流的阴极保护法的是
| A.水中的钢闸门连接电源的负极 | B.金属护拦表面涂漆 |
| C.枪炮表面涂上一层油 | D.地下钢管连接镁块 |
关于如图所示的原电池,下列说法正确的是 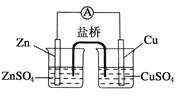
| A.锌电极发生还原反应,铜电极发生氧化反应 |
| B.盐桥中的阴离子向硫酸铜溶液中迁移 |
| C.电子从锌电极通过电流计流向铜电极 |
| D.铜电极上发生的电极反应为2H++2e-===H2↑ |
如图所示,下列叙述正确的是( ) 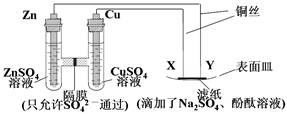
| A.隔膜左侧溶液的质量增加,隔膜右侧溶液的液面升高 |
| B.ZnSO4溶液与CuSO4溶液可以互换 |
| C.X与滤纸接触处有氧气生成 |
| D.Y与滤纸接触处有气泡产生,溶液逐渐变红 |
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)==Zn(OH)2(s)+Mn2O3(s) 下列说法错误的是
| A.电池工作时,电子由正极通过外电路流向负极 |
| B.电池工作时,锌失去电子 |
| C.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e—=Mn2O3(s)+2OH—(aq) |
| D.外电路中每通过0.2mol e-,锌的质量理论上减小6.5g |
 6Cu+SO2↑,该反应的氧化剂是_____;验证反应产生的气体是SO2的方法是____________。
6Cu+SO2↑,该反应的氧化剂是_____;验证反应产生的气体是SO2的方法是____________。
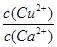 >
>