题目内容
室温下,将 4 mol A 气体和 2 mol B 气体在 2 L 的密闭容器中混合并在一定条件下发生如下反应:2A(g)+B(g)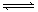 XC(g),经 2 s后反应达平衡,测得 C 的浓度为 0.6 mol·L-1 ,B的物质的量为1.4 mol,现有下列几种说法:
XC(g),经 2 s后反应达平衡,测得 C 的浓度为 0.6 mol·L-1 ,B的物质的量为1.4 mol,现有下列几种说法:
①用物质 A 表示的反应的平均速率为 0.3 mol/(L·s)
②反应前容器内的压强与平衡后容器内的压强之比为1:1
③ 2 s 时物质A的转化率为30% ④ X="2"
其中正确的是
| A.①③④ | B.①④ | C.②③ | D.③④ |
A
解析试题分析:由题意: 2A(g)+B(g)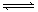 XC(g)
XC(g)
起始浓度(mol/L)2 1 0
变化浓度(mol/L)0.6 0.3 0.6
2s后平衡(mol/L)1.4 0.7 0.6
所以①用A表示的反应速率为0.6mol/L÷2s="0.3" mol/(L·s);②反应前容器内的压强与平衡后容器内的压强之比等于物质的量之比等于(2+1):(1.4+0.7+0.6)=3:2.7=1:0.9;③2 s 时物质A的转化率为30%;④浓度变化量之比等于化学计量数之比,故X=2。
考点:考查化学反应速率、化学平衡的计算。

化学平衡状态I、II、III的相关数据如下表:
| 编号 | 化学方程式 | 平衡常数 | 温度 | |
| 979K | 1173K | |||
| I | Fe(s)+CO2(g) 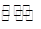 2 FeO(s)+CO(g) 2 FeO(s)+CO(g) | K1 | 1.47 | 2.15 |
| II | CO(g)+H2O(g) 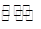 CO2(g)+H2(g) CO2(g)+H2(g) | K2 | 1.62 | b |
| III | Fe(s)+H2O(g)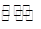 FeO(s)+H2(g) FeO(s)+H2(g) | K3 | a | 1.68 |
A.a>b B.增大压强,平衡状态II不移动
C.升高温度平衡状态III向正反应方向移动 D.反应II、III均为放热反应
对于可逆反应4NH3+5O2 4NO+6H2O(g),下列叙述不正确的是 ( )
4NO+6H2O(g),下列叙述不正确的是 ( )
| A.达到平衡时,4v(O2)正=5v(NO)逆 |
| B.达到平衡状态后,NH3、O2、NO 、H2O(g)的物质的量保持不变。 |
| C.达到平衡状态时,若增加容器体积,则反应速率增大 |
| D.若单位时间生成xmolNO的同时,生成xmolNH3,则反应达到平衡状态 |
工业制硫酸中的一步重要反应是SO2在400-500℃下的催化氧化,2SO2(g)+O2(g) 2SO3(g),这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法中错误的是
2SO3(g),这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法中错误的是
| A.达到平衡时,SO2的浓度与SO3的浓度相等 |
B.相同状况下,反应2SO3(g)  2SO2(g)+O2(g)是一个吸热反应 2SO2(g)+O2(g)是一个吸热反应 |
| C.为了提高SO2转化率,可适当提高O2浓度 |
| D.升高温度,放热反应的速率增大,吸热反应的速率也增大 |
下列有关说法正确的是
| A.若在海轮外壳上附着一些铜块,则可以减缓海轮外壳的腐蚀 |
| B.2NO(g)+2CO(g)=N2(g)+2CO2(g)在常温下能自发进行,则该反应的△H>0 |
| C.加热0.1mol/LNa2CO3溶液,CO32-的水解程度和溶液的pH均增大 |
| D.对于乙酸与乙醇的酯化反应(△H<0),加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大 |
一定条件下存在反应:C(s)+H2O(g) CO(g)+H2(g)△H>0。向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示。
CO(g)+H2(g)△H>0。向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示。
| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5 L | 0.5 L | V |
| 温度 | T1 ℃ | T2 ℃ | T1 ℃ |
| 起始量 | 2 molC 1 molH2O | 1 molCO 1 molH2 | 4 molC 2 molH2O |

下列说法正确的是
A.甲容器中,反应在前15 min的平均速率v(H2)="0.1" mol·L-1·min-1
B.丙容器的体积V<0.5 L
C.当温度为T1 ℃时,反应的平衡常数K=2.25
D.乙容器中,若平衡时n(H2O)="0.4" mol,则T1< T2
常温常压下将氢气和氧气混合在一起,即使过上几年,它们也不会发生化合反应生成水。然而只要给一个电火花,氢气就迅速与氧气反应生成水。反应过程中的能量变化如下图A所示。对比下图B中的情景,漫画中的羊供给石头的“能量”相当于图A中的( )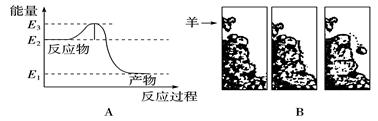
| A.E2 | B.E2-E1 | C.E3-E2 | D.E3 |
100mL 6mol/L H2SO4跟过量锌粉反应,在一定温度,为了“减缓反应进行的速率,但又不影响生成H2的总量”,可向反应物中加入适量的 ( )
| A.Na2CO3溶液 | B.Na2CO3固体 | C.水 | D.NaNO3固体 |
 2C(气)达到平衡的标志是( )
2C(气)达到平衡的标志是( )