题目内容
对于可逆反应4NH3+5O2 4NO+6H2O(g),下列叙述不正确的是 ( )
4NO+6H2O(g),下列叙述不正确的是 ( )
| A.达到平衡时,4v(O2)正=5v(NO)逆 |
| B.达到平衡状态后,NH3、O2、NO 、H2O(g)的物质的量保持不变。 |
| C.达到平衡状态时,若增加容器体积,则反应速率增大 |
| D.若单位时间生成xmolNO的同时,生成xmolNH3,则反应达到平衡状态 |
C
解析试题分析:A、达到平衡时,4v(O2)正=5v(NO)逆,正确;B、达到平衡状态后,NH3、O2、NO 、H2O(g)的物质的量保持不变,正确;C、达到平衡状态时,若增加容器体积,相当于减小压强,则反应速率减小,错误;D、若单位时间生成xmolNO的同时,生成xmolNH3,则反应达到平衡状态,正确。
考点:考查化学平衡状态的判断及影响因素。

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
浅绿色的Fe(NO3)2溶液中存在着如下的平衡:Fe2++2H2O Fe(OH)2+2H+若在此溶液中加入稀硫酸,则溶液的颜色变化为( )
Fe(OH)2+2H+若在此溶液中加入稀硫酸,则溶液的颜色变化为( )
| A.绿色变深 | B.浅绿色变得更浅 | C.变黄 | D.无明显变化 |
700℃时,向容积为1 L的密闭容器中充入一定量的CO2和H2,发生反应:
CO2+H2(g)  CO(g)+H2O(g) 反应过程中测定的部分数据见下表(表中t2>t1):
CO(g)+H2O(g) 反应过程中测定的部分数据见下表(表中t2>t1):
| 反应时间/min | n(CO2)/mol | H2/ mol |
| 0 | 1.50 | 1.00 |
| t1 | | 0.40 |
| t2 | 0.90 | |
A.反应在t1 min内的平均速率为v(H2O)=0.60 /t1 mol·L-1·min-1
B.温度升至800℃,上述反应平衡常数为1.56,则正反应为放热反应
C.保持其他条件不变,向平衡体系中再通入1.00 molH2,与原平衡相比,达到新平时CO2转化率增大,H2的体积分数增大
D.保持其他条件不变,起始时向容器中充入1.00 molCO和1.50 molH2O,到达平衡时,c(CO2)=0.90 mol/L
设C+CO2 2CO(正反应吸热),正反应的反应速率为v1;N2+3H2
2CO(正反应吸热),正反应的反应速率为v1;N2+3H2 2NH3(正反应放热),正反应的反应速率为v2。对于上述反应,当温度升高时,v1和v2的变化情况为
2NH3(正反应放热),正反应的反应速率为v2。对于上述反应,当温度升高时,v1和v2的变化情况为
| A.v1减小,v2增大 | B.同时减小 |
| C.v1增大,v2减小 | D.同时增大 |
下列图示与对应的叙述相符的是 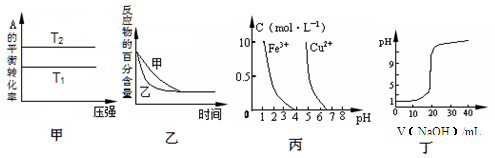
A.由图甲可以判断:对于反应aA(g)+ bB(g) cC(g),若T1>T2, 则a +b=c且 ?H<0 cC(g),若T1>T2, 则a +b=c且 ?H<0 |
B.图乙表示压强对可逆反应2A(g)+2 B(g) 3C(g)+D(s)的影响,乙的压强比甲的压强大 3C(g)+D(s)的影响,乙的压强比甲的压强大 |
| C.根据图丙,若除去CuSO4溶液中的Fe3+,可向溶液中加入适量NaOH溶液,调节pH≈4 |
| D.图丁表示用0.1000 mol/L NaOH溶液滴定20.00 mL0.1000 mol/L醋酸溶液得到的滴定曲线 |
把下列四种x的溶液,分别加入盛有10 mL、2 mol/L的盐酸的烧杯中,并均加水稀释至50mL,此时x和盐酸缓和地进行反应,其中反应速率最大的是:
| A.20 mL,2 mol/L | B.20 mL,3 mol/L | C.10 mL,5 mol/L | D.10 mL,3 mol/L |
(6分)(2012?重庆)在一个不导热的密闭反应器中,只发生两个反应:
a(g)+b(g)?2c(g);△H1<0
x(g)+3y(g)?2z(g);△H2>0
进行相关操作且达到平衡后(忽略体积改变所作的功),下列叙述错误的是( )
| A.等压时,通入惰性气体,c的物质的量不变 |
| B.等压时,通入z气体,反应器中温度升高 |
| C.等容时,通入惰性气体,各反应速率不变 |
| D.等容时,通入z气体,y的物质的量浓度增大 |
 XC(g),经 2 s后反应达平衡,测得 C 的浓度为 0.6 mol·L-1 ,B的物质的量为1.4 mol,现有下列几种说法:
XC(g),经 2 s后反应达平衡,测得 C 的浓度为 0.6 mol·L-1 ,B的物质的量为1.4 mol,现有下列几种说法: 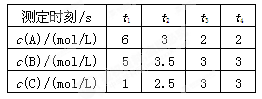
 2C
2C