题目内容
【题目】下列变化过程属于非氧化还原反应的是
A. 浓盐酸![]() Cl2 B. Cl2
Cl2 B. Cl2![]() NaClO
NaClO
C. 浓硫酸![]() SO2 D. SiO2
SO2 D. SiO2 ![]() Si
Si
【答案】C
【解析】
氧化还原反应的特征是元素化合价的升降,非氧化还原反应没有元素化合价的变化,据此分析解答。
A. HCl中的Cl元素是-1价,反应后生成Cl2,化合价由-1价升高到0价,所以发生的是氧化还原反应,A不符合题意;
B.Cl元素的化合价由反应前的0价变为反应后的+1价,化合价发生变化,是氧化还原反应,B不符合题意;
C.浓硫酸与Na2SO3反应产生Na2SO4和H2O、SO2,元素的化合价没有发生变化,因此该反应是非氧化还原反应,C符合题意;
D.SiO2与C在高温下反应产生Si和CO,元素化合价发生了变化,属于氧化还原反应,D不符合题意;
故合理选项是C。

【题目】已知乙苯制备苯乙烯的反应为:![]()
化学键 | C﹣H | C﹣C | C=C | H﹣H |
键能/KJ/mol | 412 | 348 | 612 | 436 |
下列说法错误的是
A. 上述反应的△H=+124kJmol﹣1 B. 乙苯比苯乙烯稳定
C. 乙苯中不存在碳碳双键 D. 1mol乙苯的能量与1mol苯乙烯能量相差264kJ
【题目】K2Cr2O7是一种有致癌性的强氧化剂,含Cr2O72—的酸性工业废水必须经过处理才能排放。工业上通常采用Fe电极电解法处理,调节pH值使之以Cr(OH)3沉淀形式除去。某化学兴趣小组在实验室里探究了该处理工艺,具体实验日志如下:
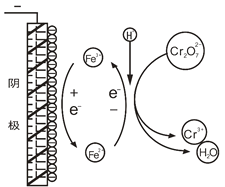
I.原理探查
查阅文献发现,电解时阳极产生Fe2+,在阴极附近(如图),Cr2O72—被Fe2+还原成Cr3+,而Fe3+则在阴极表面还原为Fe2+,如此循环。
(1)用离子方程式表示Cr2O72—与Fe2+的反应:______________________________。
II.实验探究
实验一:探究不同电压对Cr2O72-降解效率的影响
各取6份100 mL 1 mol/L 酸性K2Cr2O7溶液,均以Fe为电极,分别用不同电压电解5 min。取电解后溶液10 mL,测定Cr2O72-的含量,所测溶液中Cr2O72-物质的量与电解电压关系如下图所示。(假设电解前后溶液体积不变)
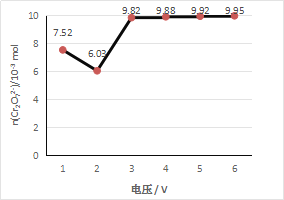
(2)实验结果显示,最佳电解电压应选择_______V。
(3)电压为6 V时,用Cr2O72-表示5 min内平均反应速率为_________mol·L—1·min—1。
(4)当电压高于3 V时,阴阳两极在电解过程中不断有气泡产生,且测得体积比约等于2:1。因此,阳极产生气泡的电极反应式为:__________________________________。
实验二:探究其他影响Cr2O72-降解效率的因素
以1A电流电解500mL K2Cr2O7稀溶液,通电时间30min,考察影响Cr2O72-降解效率的其他因素。具体方法和数据如下表所示。
实验组 | ① | ② | ③ | ④ | |
加入硫酸铁 /g | 0 | 0 | 5.0 | 0 | |
加入浓硫酸 /mL | 0 | 1.0 | 1.0 | 1.0 | |
电极材料 | 阴极 | 石墨 | 石墨 | 石墨 | 石墨 |
阳极 | 石墨 | 石墨 | 石墨 | 铁 | |
Cr2O72-浓度 / mol·L-1 | 初始 | 0.00651 | 0.00651 | 0.00651 | 0.00651 |
结束 | 0.00645 | 0.00568 | 0.00516 | 0.00278 | |
(5)以上实验中,Cr2O72-降解效率最高的是实验组_____(填编号),该实验组阳极电极反应式为:__________________________________。
(6)对比②和③,Cr2O72-降解效率③>②的原因是:__________________________。
(7)由实验组①和②,可认为Cr2O72-能直接在阴极放电还原,电极反应式为:__________________________________。
(8)法拉第提出了电解定律,为电化学的发展作出了巨大贡献。根据法拉第电解定律: Q=It=n(e-)F,[I为电流强度单位为A,t为时间单位为s,n(e-)为通过电路的电子的物质的量,F为法拉第常数(每摩电子电量,F=96500 C·mol-1)],则实验组②中的电流效率![]() =______________。(保留三位有效数字;假设电解前后溶液体积不变,且没有副反应发生。)
=______________。(保留三位有效数字;假设电解前后溶液体积不变,且没有副反应发生。)
【题目】焦炭是重要的工业原材料。
(1)已知在一定温度下,C(s)+CO2(g) ![]() 2CO(g) 平衡常数K1;C(s)+H2O(g)
2CO(g) 平衡常数K1;C(s)+H2O(g) ![]() CO(g)+H2(g) 平衡常数K2 ;CO(g)+H2O(g)
CO(g)+H2(g) 平衡常数K2 ;CO(g)+H2O(g) ![]() H2(g)+CO2(g) 平衡常数K。则K、K1、K2,之间的关系是__________。
H2(g)+CO2(g) 平衡常数K。则K、K1、K2,之间的关系是__________。
(2)用焦炭还原NO的反应为:2NO(g)+ C(s)![]() N2(g) + CO2(g) ΔH,向容积均为1L的甲、乙、丙三个恒温(反应温度分别为400℃、T ℃、400℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g) + CO2(g) ΔH,向容积均为1L的甲、乙、丙三个恒温(反应温度分别为400℃、T ℃、400℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
t/min | 0 | 40 | 80 | 120 | 160 |
n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(NO)(乙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
n(NO)(丙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
①甲容器中,0~40 min内用NO的浓度变化表示的平均反应速率v(NO)=_____________ ;
②该反应的平衡常数表达式为__________________;400℃,该反应的平衡常数为_______;
③乙容器的反应温度T____400 ℃(填“>”“<”或“=”)
④丙容器达到平衡时,NO的转化率为___________;平衡时CO2的浓度为________。
⑤在恒容密闭容器中加入焦炭并充入NO气体,下列图像正确且能说明反应达到平衡状态的是___。