题目内容
(12分)在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂过氧化氢,当它们混合时,即产生大量氧气和水蒸气,并放出大量热。已知0.4mol液态肼与足量液态过氧化氢反应,生成氮气和水蒸气,放出256.0kJ的热量。
(1)写出过氧化氢和肼的电子式:过氧化氢 ,肼 。
(2)写出液态肼与足量液态过氧化氢反应生成氮气和气态水反应的热化学方程式 。
(3)已知H2O(1)=H2O(g) △H =+44kJ/mol,则16g液态肼与足量液态过氧化氢反应生成氮气和液态水时,放出的热量是 kJ。
(4)上述反应用于火箭推进剂,除释放大量热和快速产生大量气体外,还有一个很突出的优点是 。
(1)写出过氧化氢和肼的电子式:过氧化氢 ,肼 。
(2)写出液态肼与足量液态过氧化氢反应生成氮气和气态水反应的热化学方程式 。
(3)已知H2O(1)=H2O(g) △H =+44kJ/mol,则16g液态肼与足量液态过氧化氢反应生成氮气和液态水时,放出的热量是 kJ。
(4)上述反应用于火箭推进剂,除释放大量热和快速产生大量气体外,还有一个很突出的优点是 。
(1)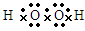
 (共4分,每空2分)
(共4分,每空2分)
(2)N2H4(1)+2H2O2(1)= N2(g)+4H2O(g) △H =-640kJ/mol(3分)
(3)408 (3分)
(4)生成N2和H2O,对环境无污染(2分)
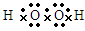
 (共4分,每空2分)
(共4分,每空2分)(2)N2H4(1)+2H2O2(1)= N2(g)+4H2O(g) △H =-640kJ/mol(3分)
(3)408 (3分)
(4)生成N2和H2O,对环境无污染(2分)
(3)由下面的两个反应,通过盖斯定律:
H2O(1)=H2O(g) △H =+44kJ/mol
N2H4(1)+2H2O2(1)= N2(g)+4H2O(g) △H =-640kJ/mol
推出:N2H4(1)+2H2O2(1)= N2(g)+4H2O(l) △H =-816kJ/mol(3分)
H2O(1)=H2O(g) △H =+44kJ/mol
N2H4(1)+2H2O2(1)= N2(g)+4H2O(g) △H =-640kJ/mol
推出:N2H4(1)+2H2O2(1)= N2(g)+4H2O(l) △H =-816kJ/mol(3分)

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
 O2 (g)
O2 (g)  2SO3,当生成2 mol SO3时放出热量为Q,现将1 mol SO2和0.5 mol O2在相同条件下反应生成SO3放出的热量为Q1,则( )
2SO3,当生成2 mol SO3时放出热量为Q,现将1 mol SO2和0.5 mol O2在相同条件下反应生成SO3放出的热量为Q1,则( ) 2NH3的能量变化如图所示,写出生成氨气时该反应的热化学方程式 。
2NH3的能量变化如图所示,写出生成氨气时该反应的热化学方程式 。