题目内容
【题目】常温下,下列说法错误的是( )
A. c(H+)为1.0×10-4mol·L-1的醋酸溶液的pH=4
B. 0.1 mol·L-1某酸溶液的pH=1
C. 0.01 mol·L-1氨水的pH<12
D. pH=3的醋酸溶液的浓度大于1.0×10-3mol·L-1
【答案】B
【解析】
A. 依据pH的定义可知,醋酸溶液的pH=-lgc(H+)=-lg(1.0×10-4)=4,A项正确;
B. 若为一元强酸,则溶液中的氢离子浓度c(H+)=0.1 mol·L-1,则pH=-lgc(H+)=1,条件不足,无法计算其pH,B项错误;
C. 一水合氨为弱碱,则0.01 mol·L-1氨水的氢氧根离子浓度c(OH-)<10-2 mol·L-1,依据![]() 可知,常温下该溶液中c(H+)>10-12mol/L,故pH<12,C项正确;
可知,常温下该溶液中c(H+)>10-12mol/L,故pH<12,C项正确;
D. pH=3的醋酸溶液中c(H+)=10-3mol/L,因醋酸为弱酸,则醋酸的浓度大于1.0×10-3mol·L-1,D项正确;
答案选B。

【题目】铜及其化合物在人们的日常生活中有着广泛的用途。回答下列问题:
(1)铜或铜盐的焰色反应为绿色,该光谱是________(填“吸收光谱”或“发射光谱”)。
(2)基态Cu原子中,核外电子占据的最低能层符号是________,其价电子层的电子排布式为___________,Cu与Ag均属于IB族,熔点:Cu________Ag (填“>”或“<”)。
(3)[Cu(NH3)4]SO4 中阴离子的立体构型是_______;中心原子的轨道杂化类型为_____,[Cu(NH3)4]SO4 中Cu2+与NH3之间形成的化学键称为_______________。
(4)用Cu作催化剂可以氧化乙醇生成乙醛,乙醛再被氧化成乙酸,等物质的量的乙醛与乙酸中σ键的数目比为_____________。
(5)氯、铜两种元素的电负性如表: CuCl属于________(填“共价”或“离子”)化合物。
元素 | Cl | Cu |
电负性 | 3.2 | 1.9 |
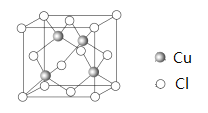
(6)Cu 与Cl 形成某种化合物的晶胞如图所示,该晶体的密度为ρ g·cm-3,晶胞边长为a cm,则阿伏加德罗常数为______________(用含ρ、a的代数式表示)。