题目内容
【题目】燃料电池具有能量利用率高、可连续使用和污染轻等优点,已成为一种发展前景十分广阔的化学电源。氢氧燃料电池是目前最成熟的燃料电池,它可以使用不同的电解质,如酸式、碱式、熔融碳酸盐、固体电解质等。回答以下问题。
(1)通人氧气的一极为___________极,若电解质溶液为硫酸溶液,负极反应式为____________,若电解质溶液为KOH溶液,正极反应式为____________。
(2)若将氢气改为CH4,电解质溶液为KOH溶液,此时负极反应式为__________,一段时间后,电解质溶液的OH-的浓度将____________(填“增大”“减小”或“不变”)。
(3)肼(N2H4)-空气燃料电池是一种碱性燃料电池,电解质溶液是20%30%的KOH溶液。已知N2H4燃烧产物之一为空气中含量最高的一种气体。肼-空气燃料电池放电时负极的电极反应式为___________________.
【答案】正 H2-2e-=2H+ O2+4e-+2H2O=4OH- CH4+10OH--8e-=![]() +7H2O 减少 N2H4+4OH--4e-=4H2O+N2
+7H2O 减少 N2H4+4OH--4e-=4H2O+N2
【解析】
燃料电池中,通入氧气的一极,得电子,化合价降低,做电池的正极;电池的负极,根据电解质溶液的不同,产物则不同。
(1)燃料电池中通入氧气的一极,氧气作氧化剂,则通入氧化剂的一极为正极,故氢氧燃料电池中通入氧气的一极为正极;H2失电子发生氧化反应,若电解质溶液为硫酸溶液,则负极反应式为H2-2e-=2H+;O2得电子发生还原反应,若电解质溶液为KOH溶液,正极反应式为O2+4e-+2H2O=4OH-。
(2)若将氢气改为CH4,CH4中-4价C元素被氧化为+4价,电解质溶液为KOH溶液,负极反应式为CH4+10OH--8e-=CO32-+7H2O;总反应式为CH4+2OH-+2O2=CO32-+3H2O,反应消耗OH-,一段时间后溶液c(OH-)减小。
(3)肼(N2H4)-空气碱性燃料电池,总反应式为N2H4+4OH--4e-=4H2O+N2,负极上N2H4失电子,氢氧根离子参与反应,生成水和氮气,负极反应式为N2H4+4OH--4e-=4H2O+N2。

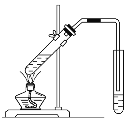
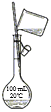
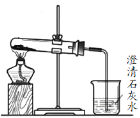
【题目】选择装置,完成实验。
|
|
|
|
① | ② | ③ | ④ |
(1)分离水和植物油,选用___(填序号,下同)。
(2)配制100mL0.1mol·L-1NaOH溶液,选用___。
(3)鉴别Na2CO3和NaHCO3固体,选用__。
(4)用乙酸、乙醇和浓硫酸制备乙酸乙酯,选用__。