题目内容
【题目】铜及其化合物在人们的日常生活中有着广泛的用途。回答下列问题:
(1)铜或铜盐的焰色反应为绿色,该光谱是________(填“吸收光谱”或“发射光谱”)。
(2)基态Cu原子中,核外电子占据的最低能层符号是________,其价电子层的电子排布式为___________,Cu与Ag均属于IB族,熔点:Cu________Ag (填“>”或“<”)。
(3)[Cu(NH3)4]SO4 中阴离子的立体构型是_______;中心原子的轨道杂化类型为_____,[Cu(NH3)4]SO4 中Cu2+与NH3之间形成的化学键称为_______________。
(4)用Cu作催化剂可以氧化乙醇生成乙醛,乙醛再被氧化成乙酸,等物质的量的乙醛与乙酸中σ键的数目比为_____________。
(5)氯、铜两种元素的电负性如表: CuCl属于________(填“共价”或“离子”)化合物。
元素 | Cl | Cu |
电负性 | 3.2 | 1.9 |
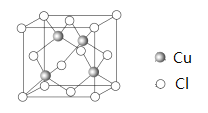
(6)Cu 与Cl 形成某种化合物的晶胞如图所示,该晶体的密度为ρ g·cm-3,晶胞边长为a cm,则阿伏加德罗常数为______________(用含ρ、a的代数式表示)。
【答案】发射光谱 K 3d104s1 > 正四面体 sp3 配位键 6:7 共价 ![]() mol-1
mol-1
【解析】
(1)基态原子的电子吸收能量,跃迁到较高能级,电子又从高能级跃迁到低能级,以光的形式释放能量;
(2)基态Cu原子的核外电子排布式为:1s22s22p63s23p63d104s1。其3d、4s能级上电子为其价电子。金属键越强,其熔沸点越高;
(3)SO42-中硫原子的价层电子对数为4,孤电子对数为0,根据价层电子互斥理论判断。Cu2+含有空轨道,NH3中氮原子有孤电子对;
(4)单键为σ键,双键含有1个σ键、1个![]() 键;
键;
(5)二者电负性的差为1.3小于1.7;
(6)推导出公式NA=![]() 计算。
计算。
(1)基态原子的电子吸收能量,跃迁到较高能级,电子又从高能级跃迁到低能级,以光的形式释放能量,为发射光谱;
(2)基态Cu原子的核外电子排布式为:1s22s22p63s23p63d104s1,核外电子占据能量最低的能层为K层,其3d、4s能级上电子为其价电子,其价电子排布式为3d104s1;Cu的离子半径比Ag的小,Cu的金属键更强,金属键越强,其熔沸点越高,所以熔沸点Cu>Ag;
(3)SO42-中硫原子的价层电子对数为4,孤电子对数为0,所以为正四面体结构且硫原子采用sp3杂化。Cu2+含有空轨道,NH3中氮原子有孤电子对,二者形成的化学键为配位键;
(4)乙醛分子中有4个C-H键、1个C-C键、1个C=O双键。乙酸分子中有4个C-H键、1个C-C键、1个C=O键、1个C-O键、1个O-H键。单键为σ键,双键含有1个σ键、1个![]() 键,所以等物质的量的乙醛与乙酸中σ键的数目比为6:7;
键,所以等物质的量的乙醛与乙酸中σ键的数目比为6:7;
(5)二者电负性的差为1.3,小于1.7,不是离子化合物,所以CuCl属于共价化合物;
(6)该晶胞中含氯原子个数=8![]() =4、铜原子4个,晶胞体积=a3cm3,晶胞密度
=4、铜原子4个,晶胞体积=a3cm3,晶胞密度![]() =
=![]() ,则NA=
,则NA=![]() mol-1=
mol-1= ![]() mol-1。
mol-1。

【题目】选择装置,完成实验。
|
|
|
|
① | ② | ③ | ④ |
(1)分离水和植物油,选用___(填序号,下同)。
(2)配制100mL0.1mol·L-1NaOH溶液,选用___。
(3)鉴别Na2CO3和NaHCO3固体,选用__。
(4)用乙酸、乙醇和浓硫酸制备乙酸乙酯,选用__。
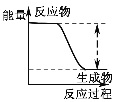
【题目】下列实验现象或图像信息不能充分说明相应的化学反应是放热反应的是( )
反应装置或图像 | 实验现象或图像信息 | |
A |
| 反应开始后,针筒活塞向右移动 |
B |
| 反应物总能量大于生成物总能量 |
C |
| 反应开始后,甲处液面低于乙处液面 |
D |
| 温度计的水银柱不断上升 |
A.AB.BC.CD.D
【题目】直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。吸收液吸收SO2的过程中,pH随n(Na2SO3):n(NaHSO3)变化关系如下表:
n(Na2SO3):n(NaHSO3) | 91:9 | 1:1 | 9:91 |
pH | 8.2 | 7.2 | 6.2 |
(1)由上表判断NaHSO3溶液显_____性,试解释原因______。
(2)pH=8.2的吸收液中由水电离出的c(OH-)______0.1molL-1NaOH溶液中由水电离出来的c(OH-)(填“>”、“<”或“=”)。
(3)将pH=8.2的吸收液蒸干得到固体的主要成分是______。
(4)若将等体积、等pH的NaOH溶液和Na2SO3溶液分别加水稀释m倍、n倍,稀释后两溶液pH仍相等,则m______n(填“<”、“>”或“=”)。
(5)25℃时,当吸收液为中性时,溶液中离子浓度关系正确的是______(选填字母)。
A c(Na+)=2c(SO![]() )+c(HSO
)+c(HSO![]() )
)
B c(Na+)>c(HSO![]() )>c(SO
)>c(SO![]() )>c(H+)=c(OH-)
)>c(H+)=c(OH-)
C c(Na+)+c(H+)=c(SO![]() )+c(HSO
)+c(HSO![]() )+c(OH-)
)+c(OH-)