��Ŀ����
����Ŀ��
�����������ž�����ҵ�Ŀ��ٷ�չ�����������������Ȼ���IJ�����Ҳ��֮Ѹ����������ˣ����Ȼ���ת��Ϊ�����ļ�����Ϊ��ѧ�о����ȵ㡣�ش��������⣺
��1��Deacon������ֱ��������Ϊ��4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)����ͼΪ���������У�����Ũ�ȱ�c(HCl) ��c(O2)�ֱ����1��1��4��1��7��1ʱHClƽ��ת�������¶ȱ仯�Ĺ�ϵ��

��֪��Ӧƽ�ⳣ��K��300�棩____________K��400�棩����������������С����������HCl��ʼŨ��Ϊc0�����ݽ���Ũ�ȱ�c(HCl)��c(O2)=1��1�����ݼ���K��400�棩=____________���г�����ʽ��������ѧ�����Ƚ��Ͽ��Ա��ַ�Ӧ���ת���ʣ�ͬʱ���Ͳ��������ܺġ�����Ũ�ȱ�c(HCl)��c(O2)���͡����ߵIJ���Ӱ��ֱ���____________��
��2��Deaconֱ���������ɰ����д����̽��У�
CuCl2(s)=CuCl(s)+![]() Cl2(g) ��H1=83 kJ��mol-1
Cl2(g) ��H1=83 kJ��mol-1
CuCl(s)+![]() O2(g)=CuO(s)+
O2(g)=CuO(s)+![]() Cl2(g) ��H2=-20 kJ��mol-1
Cl2(g) ��H2=-20 kJ��mol-1
CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ��H3=-121 kJ��mol-1
��4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)����H=_________ kJ��mol-1��
��3����һ���¶ȵ������£���һ�����HCI��ת���ʵķ�����______________����д��2�֣�
��4���ڴ�ͳ�ĵ���Ȼ���������������Ļ����ϣ���ѧ���������̼���缫���������һ���µĹ��շ�������Ҫ�����绯ѧ���̺ͻ�ѧ���̣�����ͼ��ʾ��
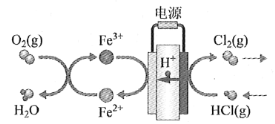
�����������ķ�Ӧ��____________________��д��Ӧ����ʽ������·��ת��1 mol���ӣ�����������__________L����״����
���𰸡����� ![]() O2��Cl2�����ܺĽϸߡ�HClת���ʽϵ� ��116 ���ӷ�Ӧ��ϵѹǿ����ʱ��ȥ���� Fe3++e=Fe2+��4Fe2++O2+4H+=4Fe3++2H2O 5.6
O2��Cl2�����ܺĽϸߡ�HClת���ʽϵ� ��116 ���ӷ�Ӧ��ϵѹǿ����ʱ��ȥ���� Fe3++e=Fe2+��4Fe2++O2+4H+=4Fe3++2H2O 5.6
��������
��1�����ݷ�Ӧ����ʽ֪��HClƽ��ת����Խ��ƽ�ⳣ��KԽ���ͼ��֪�����¶�ƽ��ת���ʽ��ͣ�˵�������¶�ƽ�����淴Ӧ������У���K(300��)>K(400��)��
��ͼ��֪��400��ʱ��HClƽ��ת����Ϊ84%��������ʽ�������ݽ��д����ã�
![]()
��ʼ��Ũ�ȣ� c0 c0 0 0
�仯��Ũ�ȣ� 0.84c0 0.21c0 0.42c0 0.42c0
ƽ�⣨Ũ�ȣ�(1-0.84)c0 (1-0.21)c0 0.42c0 0.42c0
��K=![]() �����������Ϣ֪������Ũ�ȱȹ��ͣ���������ʣ�࣬���·�������������������ܺĽϸߣ�����Ũ�ȱȹ��ߣ�HCl���ܳ�ַ�Ӧ������HClת���ʽϵͣ�
�����������Ϣ֪������Ũ�ȱȹ��ͣ���������ʣ�࣬���·�������������������ܺĽϸߣ�����Ũ�ȱȹ��ߣ�HCl���ܳ�ַ�Ӧ������HClת���ʽϵͣ�
��2�����ݸ�˹����֪������ӦI+��ӦII+��ӦIII����2��![]() H=��H1+H2+H3����2=-116kJ��mol-1��
H=��H1+H2+H3����2=-116kJ��mol-1��
��3���������HCl��ת���ʣ�Ӧ�ô�ʹƽ�������ƶ����÷�ӦΪ���������С�ķ�Ӧ��������������ԭ������������ѹǿ��ʹƽ�������ƶ���Ҳ���Լ�ʱ��ȥ�����С����Ũ�ȣ�ʹƽ�������ƶ���
��4���������У��������������Ϸ������ǵõ��ӷ�Ӧ��Ԫ�ػ��ϼ۽��ͣ����ڻ�ԭ��Ӧ����ͼ�����Ϊ������Ӧ������ͼʾ��Ϣ֪�缫��ӦΪ��Fe3++e����Fe2+��4Fe2++O2+4H+��4Fe3++2H2O����·��ת��1 mol���ӣ����ݵ��ӵ�ʧ�غ��֪���������������ʵ�����1mol��4��0.25mol���ڱ�״���µ����Ϊ0.25mol��22.4L/mol��5.6L��

����Ŀ��Ϊ��̽��Cu(NO3)2 �������Ժ����ȶ��ԣ�ij��ѧ��ȤС�����������ʵ�顣
����Cu(NO3)2 ��������
����������˿����Cu(NO3)2 ��Һ�У�һ��ʱ�����˿ȡ����Ϊ������Һ��Fe �������������Һ�е�Cu2+��������������ʵ�顣��ѡ�õ��Լ�KSCN ��Һ��K3[Fe(CN)6]��Һ����ˮ��
������±���
���� | ��Ӧ������ | ���� |
��1��ȡ�������� Cu2+�����Һ���Թ��У�����__��Һ���� | ����____ | ���� Fe3+ |
��2��ȡ�������� Cu2+�����Һ���Թ��У����� K3[Fe(CN)6]��Һ���� | ���ӷ���ʽ____ | ���� Fe2+ |
����Cu(NO3)2 �����ȶ���
����ͼ��ʾ��ʵ��װ��A �У��þƾ���ƶ�Cu(NO3)2 �����ǿ�ȣ���������ɫ���壬��װ��C���ռ�����ɫ���壬����֤ΪO2������Ӧ�����Ժ��Թ��в�������Ϊ��ɫ��


��1��װ��B ��������_______ ��
��2����ʵ�鰲ȫ�Ƕȿ��ǣ���Ҫ��A��B �����װ��M�����ڷ����л���M װ�á�_________
��3����ͼΪCu(NO3)2 ��Ʒ���¹��̵��������ߣ���Ʒ��������w%���¶ȱ仯�����ߣ���Cu(NO3)2 ���ȵ�200���Ļ�ѧ����ʽΪ___________ ������������1000������_______���ѧʽ�����塣
 ��
��
����Ŀ�������ҹ��Ƽ��ɹ����漰���ʵ�Ӧ���У�������������ѧ�仯����
|
|
|
|
A���״���������������������Դ���� | B��뮡������������̫�����˾۱�ȼ�� | C��ƫ�����������������칬�������Ļ��ȼ�� | D�����ɿ�ȼ����������Ϊ��Դʹ�� |
A. A B. B C. C D. D









