题目内容
【题目】如图所示 3 套实验装置,分别回答下列问题。
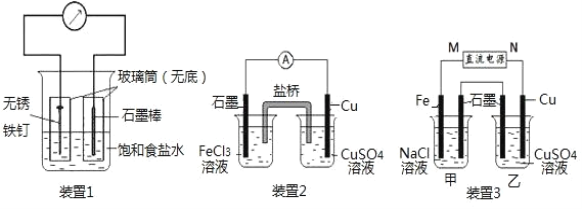
(1)装置 1 为铁的吸氧腐蚀实验。向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶 液变红,该电极反应式为_____。
(2)装置 2 中左池为氯化铁溶液,右池为硫酸铜溶液,一段时间后右池溶液中 c(Cu2+)_____(填“增大”、“减小”或“不变”),若该装置的盐桥中盛装的是 NH4NO3 的琼脂溶液,则盐桥中的_____离子(填“NH4+ ”或“NO3-”)向氯化铁溶液迁移。
(3)装置 3 中甲烧杯盛放 100mL 0.2mol/L 的 NaCl 溶液,乙烧杯盛放 100mL 0.5mol/L 的 CuSO4 溶 液。反应一段时间后,观察到乙烧杯的石墨电极上有气泡生成。
①电源的 M 端为电源_____极。
②乙烧杯中电解反应的离子方程式为_____。
③停止电解,取出 Cu 电极,洗涤、干燥、称量,电极增重 0.32g,甲烧杯中产生的气体标准状况下体积为_________mL。
④若要将乙池设计成电解精炼铜的装置,则乙池的石墨应改成____(填“粗铜”或“精铜”)。
【答案】O2+4e-+2H2O-═4OH- 增大 NH4+ 正 2Cu2++2H2O ![]() 2Cu+O2↑+4H+ 112 粗铜
2Cu+O2↑+4H+ 112 粗铜
【解析】
(1)铁发生吸氧腐蚀,铁被氧化生成Fe2+,正极发生还原反应,氧气得到电子被还原生成OH-,电极方程式为O2+4e-+2H2O-═4OH-,
故答案为:O2+4e-+2H2O-═4OH-;
(2)此装置为原电池,铜失电子作负极Cu-2e-═Cu2+,铁离子在铜电极上得电子2Fe3++2e-═2Fe2+,故石墨做正极;将正负极反应相加即得总反应:2Fe3++Cu═2Fe2++Cu2+,根据电池反应,一段时间后右池溶液中 c(Cu2+)增大,原电池放电过程中,阳离子向正极移动,阴离子向负极移动,若该装置的盐桥中盛装的是 NH4NO3 的琼脂溶液,则盐桥中的NH4+向氯化铁溶液迁移,NO3-向硫酸铜溶液迁移,
答案为:增大;NH4+;
(3)①反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红,说明在石墨电极上生成OH-离子,电极反应为:2H2O+2e-═2OH-+H2↑,发生还原反应,为电解池的阴极,连接电源的负极,即M端为正极,N端为负极,阳极反应为Fe-2e-═Fe2+,故答案为:正;
②乙烧杯电解硫酸铜溶液,石墨为阳极,电极反应为4OH--4e-═O2↑+H2O,Cu为阴极,电极反应为Cu2++2e-═Cu,电解的总反应为2 Cu2++2H2O ![]() 2Cu+O2↑+4H+,
2Cu+O2↑+4H+,
故答案为:2 Cu2++2H2O ![]() 2Cu+O2↑+4H+
2Cu+O2↑+4H+
③取出Cu电极,洗涤、干燥、称量、电极增重0.32g,则生成Cu的物质的量为![]() =0.005mol,转移的电子的物质的量为0.005mol×2=0.01mol,根据甲烧杯产生气体的电极反应计算生成气体的体积,
=0.005mol,转移的电子的物质的量为0.005mol×2=0.01mol,根据甲烧杯产生气体的电极反应计算生成气体的体积,
2H2O+2e-═2OH-+H2↑,
2mol 22.4L
0.01mol V
V=![]() =0.112L,即112ml,
=0.112L,即112ml,
故答案为:112;
④在铜的精炼装置中,粗铜在阳极发生氧化反应失电子生成铜离子,电极式为:Cu-2e-=Cu2+,精铜在阴极,电解质溶液中的铜离子在精铜表面得电子生成铜单质,电极式为:Cu2++2e-=Cu;若要将乙池设计成电解精炼铜的装置,乙池的铜电极与电源负极相连做阴极,则乙池的石墨应改成粗铜做阳极。
答案为:粗铜。

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案【题目】前四周期的A、B、C、D四种元素在周期表中均与元素X紧密相邻。已知元素X最高价氧化物的化学式为X2O5,B、D同主族且B元素的原子半径是同族元素中最小的,C的最高价氧化物对应的水化物是强酸。
(1)D元素基态原子的外围电子排布式为____________________。
(2)A、C、X三种元素原子的第一电离能由大到小的顺序为________________(用相应的元素符号作答)。
(3)B、X、D氢化物的沸点由高到低的顺序为_______________(用相应的化学式作答)。
(4)C元素的原子可形成多种离子,试推测下列微粒的立体构型(C为字母,不是碳元素):
微粒 | CO32- | CO42- |
立体构型名称 | _______________ | _______________ |
(5)元素B的一种氢化物B2H4具有重要的用途。有关B2H4的说法正确的是_______。
A.B2H4分子间可形成氢键 B.B原子是sp3杂化
C.B2H4分子中含有5个σ键和1个π键 D.B2H4晶体变为液态时破坏共价键
(6)E元素和D元素在同一周期,属于VIII族,价层有三个单电子,E(OH)2为两性氢氧化物,在浓的强碱溶液中可形成E(OH)42-,写出E(OH)2酸式电离的电离方程式___________________。
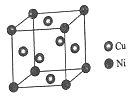
(7)F元素基态原子M层上有5对成对电子,F形成的单质有δ、γ、α三种同素异形体,三种晶胞(如图所示)中F原子的配位数之比为___________,δ、γ、α三种晶胞的边长之比为_____________。