题目内容
【题目】如图所示,一密闭容器被无摩擦、可滑动的两隔板a和b分成甲、乙两室.标准状况下,在乙室中充入0.6molHCl,甲室中充入NH3、H2的混合气体,静止时活塞位置下图.已知甲、乙两室中气体的质量之差为10.9g.
请回答下列问题:
(1)甲室中气体的物质的量为mol.
(2)甲室中气体的质量为g.
(3)甲室中NH3、H2的物质的量之比为 , 质量比为 .
(4)经过查资料知道HCl+NH3=NH4Cl(NH4Cl常温下是固体),如果将板a去掉,当HCl与NH3完全反应后,活塞b将静置于刻度“”处(填数字).
【答案】
(1)1.0
(2)11.0
(3)3:2;51:4
(4)2
【解析】解:(1)相同条件下,气体的物质的量之比等于其体积之比,看图可知甲、乙两室气体的体积比为5:3,故其物质的量之比为5:3,所以甲室中气体为1.0mol,所以答案是:1.0;(2)HCl气体的质量为0.6mol×36.5g/mol=21.9g,则甲室中气体的质量为21.9g﹣10.9g=11.0g,所以答案是:11.0;(3)设氨气的物质的量为x,氢气的物质的量为y,根据其物质的量、质量列方程组为: ![]() ,
, ![]() 所以氨气和氢气的物质的量之比=0.6mol:0.4mol=3:2,其质量之比=(0.6mol×17g/mol):(0.4mol×2g/mol)=51:4,所以答案是:3:2;51:4;(4)甲室中NH3的物质的量为1.0mol×3/5=0.6mol,恰好等于HCl的物质的量,所以二者恰好完全反应生成NH4Cl固体,剩余H2的物质的量为0.4mol,相同条件下,气体的体积之比等于其物质的量之比,所以活塞b将会左移至“2”处,所以答案是:2.
所以氨气和氢气的物质的量之比=0.6mol:0.4mol=3:2,其质量之比=(0.6mol×17g/mol):(0.4mol×2g/mol)=51:4,所以答案是:3:2;51:4;(4)甲室中NH3的物质的量为1.0mol×3/5=0.6mol,恰好等于HCl的物质的量,所以二者恰好完全反应生成NH4Cl固体,剩余H2的物质的量为0.4mol,相同条件下,气体的体积之比等于其物质的量之比,所以活塞b将会左移至“2”处,所以答案是:2.

【题目】右下图中P是可自由平行滑动的活塞。在相同温度时,向A容器中充入2 mol SO3(g),关闭K,向B容器中充入1 mol SO3(g),两容器分别发生反应:2SO3(g) ![]() 2SO2(g)+O2(g)。已知起始时容器A和B的体积均为a L。试回答:
2SO2(g)+O2(g)。已知起始时容器A和B的体积均为a L。试回答:
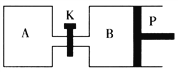
(1)反应达到平衡时容器B的体积变为1.2aL,容器B中SO3转化率为___________。
(2)若打开K,一段时间后重新达到平衡,容器B的体积为___________L(连通管中气体体积忽略不计)。
(3)将不同物质的量的H2O(g)和 CO分别通入体积为2L的恒容密闭容器中,发生反应:H2O(g)+CO(g)![]() CO2(g)+H2(g) △H,得到如下数据:
CO2(g)+H2(g) △H,得到如下数据:
实验 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | CO | H2 | |||
Ⅰ | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
Ⅱ | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
Ⅲ | 900 | 2 | 1 | a | b | t |
①由表中数据可知该反应的△H_______ 0(填“>”或“<”)。
②实验Ⅲ中a=______,达平衡时实验Ⅱ和实验Ⅲ中H2O(g)的转化率的大小关系为:α2(H2O)____α3(H2O)(填“>”、“<”或“=”)。


