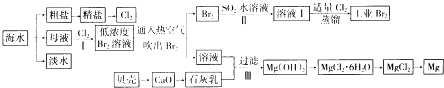
题目内容
【题目】A、B、C、D、E五种物质中均含有同一种非金属元素,它们能发生如图所示的转化关系,该元素(用R)表示)的单质能与NaOH溶液反应生成盐(Na2RO3)和氢气.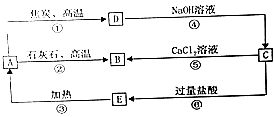
(1)写出各物质的化学式:A;C .
(2)写出反应①的化学方程式该反应中氧化剂与还原剂的物质的量之比为 .
(3)写出反应④的离子方程式: .
(4)写出反应⑤的离子方程式 .
(5)H2CO3的酸性强于E的酸性,请用离子方程式予以证明: .
【答案】
(1)SiO2;Na2SiO3
(2)2C+SiO2 ![]() Si+2CO;1:2
Si+2CO;1:2
(3)Si+2OH﹣+H2O=SiO32﹣+2H2↑
(4)SiO ![]() +Ca2+=CaSiO3↓
+Ca2+=CaSiO3↓
(5)SiO ![]() +CO2+H2O=H2SiO3↓+CO
+CO2+H2O=H2SiO3↓+CO ![]()
【解析】解:非金属单质R能与NaOH溶液反应生成盐(Na2RO3)和氢气,则R为Si元素,由转化关系可知D为Si,A为SiO2 , B为CaSiO3 , C为Na2SiO3 , E为H2SiO3 , (1)由以上分析可知A为SiO2 , C为Na2SiO3 , 所以答案是:SiO2;Na2SiO3;(2)反应①的化学方程式为2C+SiO2 ![]() Si+2CO,根据方程式可知,该反应中氧化剂与还原剂的物质的量之比为1:2,所以答案是:2C+SiO2
Si+2CO,根据方程式可知,该反应中氧化剂与还原剂的物质的量之比为1:2,所以答案是:2C+SiO2 ![]() Si+2CO;1:2;(3)反应④的离子方程式为Si+2OH﹣+H2O=SiO
Si+2CO;1:2;(3)反应④的离子方程式为Si+2OH﹣+H2O=SiO ![]() +2H2↑,所以答案是:Si+2OH﹣+H2O=SiO
+2H2↑,所以答案是:Si+2OH﹣+H2O=SiO ![]() +2H2↑;(4)反应⑤的离子方程式为SiO
+2H2↑;(4)反应⑤的离子方程式为SiO ![]() +Ca2+=CaSiO3↓,所以答案是:SiO
+Ca2+=CaSiO3↓,所以答案是:SiO ![]() +Ca2+=CaSiO3↓;(5)H2CO3的酸性强于H2SiO3的酸性,可在硅酸钠溶液中通入二氧化碳,如生成硅酸沉淀,可说明,反应的离子方程式为SiO
+Ca2+=CaSiO3↓;(5)H2CO3的酸性强于H2SiO3的酸性,可在硅酸钠溶液中通入二氧化碳,如生成硅酸沉淀,可说明,反应的离子方程式为SiO ![]() +CO2+H2O=H2SiO3↓+CO
+CO2+H2O=H2SiO3↓+CO ![]() ,所以答案是:SiO
,所以答案是:SiO ![]() +CO2+H2O=H2SiO3↓+CO
+CO2+H2O=H2SiO3↓+CO ![]() .
.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】右下图中P是可自由平行滑动的活塞。在相同温度时,向A容器中充入2 mol SO3(g),关闭K,向B容器中充入1 mol SO3(g),两容器分别发生反应:2SO3(g) ![]() 2SO2(g)+O2(g)。已知起始时容器A和B的体积均为a L。试回答:
2SO2(g)+O2(g)。已知起始时容器A和B的体积均为a L。试回答:
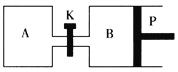
(1)反应达到平衡时容器B的体积变为1.2aL,容器B中SO3转化率为___________。
(2)若打开K,一段时间后重新达到平衡,容器B的体积为___________L(连通管中气体体积忽略不计)。
(3)将不同物质的量的H2O(g)和 CO分别通入体积为2L的恒容密闭容器中,发生反应:H2O(g)+CO(g)![]() CO2(g)+H2(g) △H,得到如下数据:
CO2(g)+H2(g) △H,得到如下数据:
实验 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | CO | H2 | |||
Ⅰ | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
Ⅱ | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
Ⅲ | 900 | 2 | 1 | a | b | t |
①由表中数据可知该反应的△H_______ 0(填“>”或“<”)。
②实验Ⅲ中a=______,达平衡时实验Ⅱ和实验Ⅲ中H2O(g)的转化率的大小关系为:α2(H2O)____α3(H2O)(填“>”、“<”或“=”)。