��Ŀ����
����Ŀ�������廯���ﷱ�࣬ijУ�о���ѧϰС���������о���
�о�1��ѡ����ͼװ����װ�Ʊ����������NH3��̽��NH3��CuO�����ķ�Ӧ��ͬʱ������ռ��ǹ�̬�����ʾ��ÿ��װ��ֻʹ��һ�Σ�����ش��������⣺
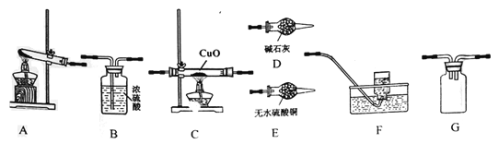
(1)���ʵ������װ�ð�������������ҵ�����˳��ΪA-��______��-��______��-��______��-G-B-��______��
(2)װ��A�з�����Ӧ�Ļ�ѧ����ʽΪ_________��
(3)D��ʢ�ż�ʯ�ҵ�����������________��Eװ�õ�������______��
(4)ͨ����һ����ⷢ��F���ռ�����������һ�ֳ����ĵ������壬Ӳ�ʲ������еõ�һ�ֹ��嵥�ʡ���������С��ͬѧ���ܹ۲쵽����������Ϊ����C��_____����E��___��C�з�Ӧ�Ļ�ѧ����ʽΪ��_______
�о�2����32gͭ��150mLһ��Ũ�ȵ����ᷴӦ��ͭ��ȫ�ܽ⣬������NO��NO2��������ڱ�״���µ����Ϊ11.2L����ش�
(5)�ڱ���£�NO�����Ϊ______L��NO2�����Ϊ______L��
(6)��������������ȫ���ͷź�����Һ�м���VmLa mol/L��NaOH��Һ��ǡ��ʹ��Һ�е�Cu2+ȫ��ת��Ϊ��������ԭ������Һ��Ũ��Ϊ____mol/L�����ú�a��V��ʽ�ӱ�ʾ��
���𰸡�D C E F 2NH4C1+Ca(OH)2![]() CaCl2+2NH3��+2H2O ���θ���� ����NH3��CuO��Ӧ�IJ������Ƿ���ˮ���� C�к�ɫ������죬�Թܱ�����Һ����� E�а�ɫ�������� 2NH3+3CuO
CaCl2+2NH3��+2H2O ���θ���� ����NH3��CuO��Ӧ�IJ������Ƿ���ˮ���� C�к�ɫ������죬�Թܱ�����Һ����� E�а�ɫ�������� 2NH3+3CuO![]() 3Cu+3H2O+N2 5.6 5.6
3Cu+3H2O+N2 5.6 5.6 ![]() (����������Ҳ��)
(����������Ҳ��)
��������
(1)����Aװ���Ʊ�NH3����װ��D���ﰱ�����ٽ�����İ���ͨ��Cװ�ã�����ȵ�CuO��Ӧ��������ˮ����ͭ�����Ƿ���ˮ���ɣ�����Fװ���ռ���Ӧ���ɵ����壬�ݴ˷�������װ�ã�
(2)ʵ�������Ȼ�狀���ʯ�ҷ�Ӧ�Ʊ�������
(3)���������Ľṹ������ȷ������D�����ƣ���ˮ����ͭ��ˮ��������ɫ��
(4)����F���ռ�����������һ�ֳ����ĵ������壬Ӳ�ʲ������еõ�һ�ֺ�ɫ���嵥�ʣ���ϻ�ѧ��Ӧ�ı��ʣ���Ӧǰ��Ԫ�ز������ı䣬��֪������Ϊͭ��������ˮ���Դ���д��ѧ����ʽ��
(5)���ݷ�Ӧ�����е���ת����Ŀ��ȣ����ԭ����Ŀ��ȣ��ɼ����NO��NO2�������
(6)����NԪ���غ㣬���Cuʧȥ���ӵ����ʵ����뷴Ӧ�õ���Cu2+��ϵ�OH-���ʵ�����ȣ�������ʵ���Ũ�ȶ���ʽ���㡣
(1)��Aװ���Ʊ���NH3ͨ��D��ʢװ�ļ�ʯ�Ҹ��������ͨͨ�����ȵ�CuO��Ӧ��Ӧ����E����ˮ����ͭ����ˮ�IJ�����������Gװ�÷�ֹ��������ķ�����������B�е�Ũ��������δ��Ӧ�İ������������Fװ���ռ���Ӧ���ɵ����壬ͬʱҲ���ð�������������ˮ��δ��Ӧ�İ�����ˮ���գ���װ������˳��ΪADCEGBF��
(2)��ʵ�������Ȼ�狀���ʯ�ҷ�Ӧ�Ʊ���������Ӧ�Ļ�ѧ����ʽΪ2NH4C1+Ca(OH)2![]() CaCl2+2NH3��+2H2O��
CaCl2+2NH3��+2H2O��
(3)D��ʢ�ż�ʯ�ҵ��������������θ���ܣ�װ��E����ˮ����ͭ��ˮ��������ɫ����ɼ���NH3��CuO��Ӧ�IJ������Ƿ���ˮ���ɣ�
(4)C�к�ɫ�Ĺ���CuO��Ϊ��ɫ���嵥�����ʣ��ú�ɫ���嵥����Cu����ˮCuSO4����ɫ��˵����Ӧ������ˮ��ͬʱ����һ������Ⱦ�����壬���˵������ͭ��������ˮ��C�з�����Ӧ�Ļ�ѧ����ʽΪ��2NH3+3CuO![]() 3Cu+3H2O+N2��
3Cu+3H2O+N2��
(5)n(Cu)=32g��64g/mol=0.5mol�����跴Ӧ������NO��NO2�����ʵ���Ϊx��y������ݵ����غ�ɵ�2��0.5mol=3x+y������Nԭ���غ�ɵ�x+y=11.2L��22.4L/mol�����x=0.25mol��y=0.25mol������V(NO)=0.25mol��22.4L/mol=5.6L��V(NO2)=0.25mol��22.4L/mol=5.6L��
(6)HNO3�ڷ�Ӧ�е����ã�һ���ֱ�ΪCu(NO3)2������γ������Σ���һ���ֱ�ΪNO��NO2��n(HNO3)=2n[Cu(NO3)2]+n(NO)+n(NO2)�������NaOH�����ʵ�����������ͭ����������ӵ����ʵ���������n(HNO3)=aV��10-3mol+0.5mol���������ʵ���Ũ�ȶ���ʽ�ɵ�c(HNO3)=![]() mol/L��
mol/L��