��Ŀ����
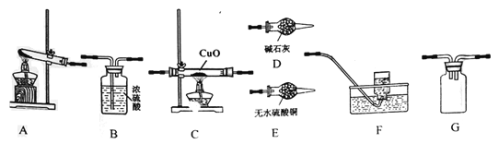
����Ŀ����.��ͼ����ѧ��ѧ�г����ڻ����ķ�����ᴿ��װ�ã������װ�ûش����⣺
(1) װ��C�Тٵ�������____________����ȴˮ�ķ�����____________��
(2) ���Ȼ�����Һ�еõ��Ȼ��ƹ��壬ѡ��װ��______(�����װ��ͼ����ĸ����ͬ)����ȥ����ˮ�е�Cl�������ʣ�ѡ��װ��________����������ˮ��Cl���Ƿ�����ķ���Ϊ��ȡ������ƿ�е�ˮ�ڽྻ�Թ��У��μ�_________��Һ����������ɫ��������Cl���ѳ�����
��.��ijͬѧ��ͨ��ʵ��̽�����̼�õ���������ǿ����ͨ���Ƚ���������������Ӧˮ���������ǿ������֤���������ͼʵ�飬��ش�
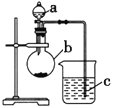
(1) ����a��������__________��Ӧʢ������ҩƷ�е�__________(����ĸ)��
A.ϡ���� B.������ C.������ D.����
(2) ����b��������__________��Ӧʢ������ҩƷ�е�__________(����ĸ)��
A.̼��� B.������ C.�Ȼ��� D.̼����
(3) ����c��Ӧʢ�ŵ�ҩƷ��__________�����������������__________��֤��b�з�Ӧ������__________������֤��_______��_________����ǿ���õ�������________��________ǿ��
���𰸡�������ƿ �½��ϳ� B C ϡ�������������Һ ��Һ©�� A Բ����ƿ D ����ʯ��ˮ ����ʯ��ˮ����� CO2 H2SO4(������) H2CO3(��̼��) S(����) C (��̼)
��������
��.(1)���ݳ��������Ľṹ����״�ж�ͼʾ������װ��CΪ����װ�ã�Ϊ�������ȴЧ����װ��C����ȴˮ����������ԭ����
(2)���Ȼ�����Һ�еõ��Ȼ��ƹ��壬Ӧ������������ȥ����ˮ�е�Cl-�����ʣ�Ӧ��������Cl-��������ϡ�������������Һ���飻
��.(1)��������������ˮ���������ǿ���ȽϷǽ����Ե�ǿ����Ӧ��ѡ��ϡ������̼���η�Ӧ��ԭ����֤��
(2)����(1)�ķ�����b�е�ҩƷӦ��Ϊ̼���Σ����̼��ƺ�̼���Ƶ����ʷ����жϣ�
(3)ϡ������̼���η�Ӧ���ɶ�����̼�����ݶ�����̼�ļ��������������
��.(1)����ͼʾ��װ��C�Т�Ϊ������ƿ��Ϊ�������ȴЧ����װ��C����ȴˮ�����½��ϳ����ʴ�Ϊ��������ƿ���½��ϳ���
(2)���Ȼ�����Һ�еõ��Ȼ��ƹ��壬Ӧ����������ѡ��װ��B����ȥ����ˮ�е�Cl-�����ʣ�Ӧ��������ѡ��װ��C����������ˮ��Cl-�Ƿ�����ķ���Ϊ��ȡ������ƿ�е�ˮ�ڽྻ�Թ��У��ȼ����ᣬ�������������������ɫ��������Cl���ѳ������ʴ�Ϊ��B��C��ϡ�������������Һ��
��.(1)�ȽϷǽ����Ե�ǿ��ʱ�õ�������������ˮ���������ǿ��������ͼʾ��a����Ϊ��Һ©�����ڷ�Һ©����ʢ�ŵ���ϡ���ᣬ��Բ����ƿ��ʢ�ŵ���̼���Σ��ʴ�Ϊ����Һ©����A��
(2)����ͼʾ��bΪԲ����ƿ��̼�����ϡ���ᷴӦ���ɵ��������һ������ḽ����̼��Ƶı��棬����ֹ��Ӧ�Ľ��У�����ѡȡ��̼����Ϊ��Ӧ��ʴ�Ϊ��Բ����ƿ��D��
(3)ֻҪ֤��Բ����ƿ���ж�����̼���ɣ�����˵����������Ա�̼�������ǿ����˵����ķǽ����Ա�̼ǿ�������Ҫ�ó���ʯ��ˮ���������̼�����ɣ������dz���ʯ��ˮ����ǣ�����c���Լ��dz���ʯ��ˮ��b�з����ķ�ӦΪCO32-+2H+�TCO2��+H2O���ʴ�Ϊ������ʯ��ˮ������ʯ��ˮ����ǣ�CO2��H2SO4(������)��H2CO3(��̼��)��S(����)��C (��̼)��