题目内容
【题目】如图所示,烧杯内盛有浓硝酸,在烧杯内放入用铜线连接的铁、铅两个电极,已知,原电池停止工作时,Fe、Pb均有剩余。下列说法正确的是( )
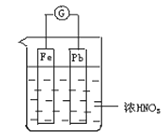
A. Fe比Pb活泼,始终做负极
B. Fe在浓硝酸中钝化始终不溶解。
C. 电池停止工作时,有Fe(NO3)3生成
D. 利用浓硝酸作电解液不符合“绿色化学”的思想
【答案】D
【解析】
A. 开始时,浓硝酸能使铁发生钝化,铅失电子作负极,铁电极是正极,随着反应的进行,硝酸的浓度逐渐降低,而稀硝酸能溶解铁,所以后阶段,相对活泼的铁失电子作负极,相对稳定的铅是正极,A项错误;
随着反应的进行,硝酸的浓度逐渐降低,而稀硝酸能溶解铁,B项错误;
C. 因为反应结束时铁有剩余,溶液中不可能三价铁离子生成,C项错误;
D. 利用浓硝酸做电解质溶液发生反应的方程式是:4H++2NO3-+2e-=2NO2↑+2H2O,有污染性气体二氧化氮生成,不符合“绿色化学”思想,D项正确;
答案选D。

练习册系列答案
相关题目