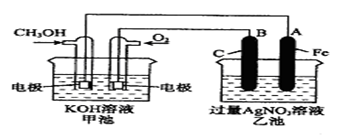
题目内容
用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂—KNO3的U形管)构成一个原电池。以下有关该原电池的叙述正确的是( )
①在电路中,电路由铜电极流向银电极
②正极反应为:Ag+ + e— ="=" Ag
 ③实验过程中取出盐桥,原电池仍继续工作
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与原电池反应相同
①在电路中,电路由铜电极流向银电极
②正极反应为:Ag+ + e— ="=" Ag
 ③实验过程中取出盐桥,原电池仍继续工作
③实验过程中取出盐桥,原电池仍继续工作④将铜片浸入AgNO3溶液中发生的化学反应与原电池反应相同
| A.①② | B.②③ | C.②④ | D.③④ |
A
略

练习册系列答案
相关题目
 Pb(s)+PbO2(s)+2H2SO4(aq),下面是关于铅蓄电池的一些说法:
Pb(s)+PbO2(s)+2H2SO4(aq),下面是关于铅蓄电池的一些说法: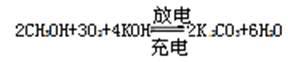
 7N2+12 H2O可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。
7N2+12 H2O可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。 2SO3(g) ΔH=—196.6 kJ·mol-1
2SO3(g) ΔH=—196.6 kJ·mol-1 ▲ ,通过计算所得的数据和简洁的文字说明电离常数、电离度与弱电解质的初始浓度的关系 ▲ 。
▲ ,通过计算所得的数据和简洁的文字说明电离常数、电离度与弱电解质的初始浓度的关系 ▲ 。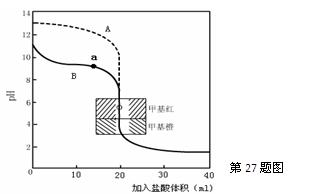
 2Ni(OH)2+Cd(OH)
2Ni(OH)2+Cd(OH) 2以下说法中正确的是:( )
2以下说法中正确的是:( )