题目内容
(10分)研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)利用反应6NO2+ 8NH3 7N2+12 H2O可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。
7N2+12 H2O可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。
(2)已知:2SO2(g)+O2(g) 2SO3(g) ΔH=—196.6 kJ·mol-1
2SO3(g) ΔH=—196.6 kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH=—113.0 kJ·mol-1
2NO2(g) ΔH=—113.0 kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH= kJ·mol-1。
SO3(g)+NO(g)的ΔH= kJ·mol-1。
(3)铁镍蓄电池又称爱迪生电池,放电时的总反应为:Fe+Ni2O3+3H2O= Fe(OH)2+2Ni(OH)2
当电池放电时,正极电极反应式为 。
(1)利用反应6NO2+ 8NH3
 7N2+12 H2O可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。
7N2+12 H2O可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。(2)已知:2SO2(g)+O2(g)
 2SO3(g) ΔH=—196.6 kJ·mol-1
2SO3(g) ΔH=—196.6 kJ·mol-12NO(g)+O2(g)
 2NO2(g) ΔH=—113.0 kJ·mol-1
2NO2(g) ΔH=—113.0 kJ·mol-1则反应NO2(g)+SO2(g)
 SO3(g)+NO(g)的ΔH= kJ·mol-1。
SO3(g)+NO(g)的ΔH= kJ·mol-1。(3)铁镍蓄电池又称爱迪生电池,放电时的总反应为:Fe+Ni2O3+3H2O= Fe(OH)2+2Ni(OH)2
当电池放电时,正极电极反应式为 。
(共10分)
(1)6.72(3分)
(2)- 41.8(3分)
(3)Ni2O3+3H2O+2e-=2Ni(OH)2+2OH-(4分)
(1)6.72(3分)
(2)- 41.8(3分)
(3)Ni2O3+3H2O+2e-=2Ni(OH)2+2OH-(4分)
⑴NO2在标准状况下
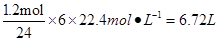
⑵①2SO2(g)+O2(g)
 2SO3(g) ΔH=—196.6 kJ·mol-1
2SO3(g) ΔH=—196.6 kJ·mol-1②2NO(g)+O2(g)
 2NO2(g) ΔH=—113.0 kJ·mol-1
2NO2(g) ΔH=—113.0 kJ·mol-1(①―②)÷2得:(—196.6 kJ·mol-1+113.0 kJ·mol-1)÷2=- 41.8 kJ·mol-1
⑶)Ni2O3+3H2O+2e-=2Ni(OH)2+2OH-

练习册系列答案
 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目

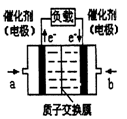

 ③实验过程中取出盐桥,原电池仍继续工作
③实验过程中取出盐桥,原电池仍继续工作 2CO2+4H2O。(已知甲醇的标准燃烧热为-725.76kJ ·mol-1)
2CO2+4H2O。(已知甲醇的标准燃烧热为-725.76kJ ·mol-1)
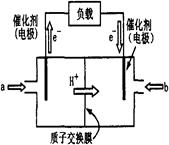
 2CO2(g)+4H2O(g),试写出该条件下反应的平衡常数表达式K= ; 在电脑的使用过程中,电池的温度往往因为各种原因会升高,试判断温度升高时该反应的平衡常K将 (填增大、减小、不变),其反应的正反应速率将 (填增大、减小、不变);逆反应速率将 (填增大、减小、不变);温度升高 (填有利或不利于)电池将化学能转化为电能。
2CO2(g)+4H2O(g),试写出该条件下反应的平衡常数表达式K= ; 在电脑的使用过程中,电池的温度往往因为各种原因会升高,试判断温度升高时该反应的平衡常K将 (填增大、减小、不变),其反应的正反应速率将 (填增大、减小、不变);逆反应速率将 (填增大、减小、不变);温度升高 (填有利或不利于)电池将化学能转化为电能。 +b kJ·mol-1。若常温下一定量的甲醇完全燃烧生成液态水释放出了1451.52 kJ的能量,则等质量的甲醇利用图示装置理论上可提供 mol电子的电量。
+b kJ·mol-1。若常温下一定量的甲醇完全燃烧生成液态水释放出了1451.52 kJ的能量,则等质量的甲醇利用图示装置理论上可提供 mol电子的电量。 体可以混合从而省去了昂贵的燃料隔离膜。下列对其工作原理叙述正确的是
体可以混合从而省去了昂贵的燃料隔离膜。下列对其工作原理叙述正确的是 