题目内容
6.下列实验设计合理或能够达到实验目的是( )| A. |  分离碘酒中的碘和酒精 | B. |  除去Cl2中HCl | ||
| C. | 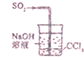 吸收SO2气体 | D. |  收集NH3并吸收多余NH3 |
分析 A.碘易溶于酒精,不分层;
B.氯气、HCl均与NaOH溶液反应;
C.四氯化碳隔绝气体与NaOH溶液;
D.氨气可利用碱石灰干燥,其密度比空气的密度小,极易溶于水.
解答 解:A.碘易溶于酒精,不分层,不能利用图中分液漏斗分离,故A错误;
B.氯气、HCl均与NaOH溶液反应,则不能利用NaOH、洗气除杂,应选试剂为饱和食盐水,故B错误;
C.四氯化碳隔绝气体与NaOH溶液,则图中装置可防止倒吸,故C正确;
D.氨气可利用碱石灰干燥,其密度比空气的密度小,极易溶于水,则图中干燥、向下排空气法收集及防倒吸装置均合理,故D正确;
故选CD.
点评 本题考查化学实验方案的评价,为高频考点,涉及混合物分离提纯、防倒吸、气体的收集等,把握物质的性质、实验技能为解答的关键,注意实验的评价性分析,题目难度不大.

练习册系列答案
 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案
相关题目
16.中国科学技术大学的钱逸泰教授等以CCl4和金属钠为原料,在700℃时制造出纳米级金刚石粉末(粉末直径为10-9~10-7m)的颗粒.该成果发表在世界权威的《科学》杂志上,立刻被科学家们高度评价为“稻草变黄金”.下列有关说法错误的是( )
| A. | 该金刚石粉末与水混和后能产生丁达尔现象 | |
| B. | 该反应属于置换反应 | |
| C. | CCl4和CH4在常温下均为无色气体 | |
| D. | 金刚石属于非金属单质 |
1.下列说法中错误的是( )
| A. | 35Cl和37Cl互为同位素 | |
| B. | 元素的化学性质主要取决于核外电子数 | |
| C. | 物质之间发生化学变化时,化学键一定发生变化 | |
| D. | 熔融状态下能够导电的化合物一定是离子化合物 |
11.生活处处有化学.下列说法不正确的是( )
| A. | 纤维素、蛋白质都是有机高分子化合物 | |
| B. | 苯、甲苯等是煤的主要成分 | |
| C. | 花生油、牛油都是酯类 | |
| D. | 豆浆、牛奶可作为误食重金属盐的解毒剂 |
18.向一密闭容器中充入1molN2和3molH2,在-定条件下发生反应N2+3H2?2NH3,下列有关说法正确的是( )
| A. | 当达到化学平衡时,N2的浓度保持不变 | |
| B. | 反应最终可生成2molNH3 | |
| C. | 当达到化学平衡时.正反应和逆反应的速率都为0 | |
| D. | 当反应达到化学平衡时,N2、H2、NH3的分子数比一定为1:3:2 |
15. 光刻胶是大规模集成电路印刷电路版技术中的关键产物,某一光刻胶的主要成分如图所示,下列有关说法正确的是( )
光刻胶是大规模集成电路印刷电路版技术中的关键产物,某一光刻胶的主要成分如图所示,下列有关说法正确的是( )
 光刻胶是大规模集成电路印刷电路版技术中的关键产物,某一光刻胶的主要成分如图所示,下列有关说法正确的是( )
光刻胶是大规模集成电路印刷电路版技术中的关键产物,某一光刻胶的主要成分如图所示,下列有关说法正确的是( )| A. | 合成此高聚物的单体的化学式为C11H10O2 | |
| B. | 该物质可稳定存在于碱性溶液中 | |
| C. | 1mol该物质最多可与3molH2发生加成反应 | |
| D. | 该物质可经过缩聚反应制得 |
16.氮的固定是几百年来科学家一直研究的课题.
(1)下表列举了不同温度下大气固氮的部分K值.
①分析数据可知:大气固氮反应属于吸热(填“吸热”或“放热”)反应.
②分析数据可知:人类不适合大规模模拟大气固氮的原因K值小,正向进行的程度小(或转化率低),不适合大规模生产.
(2)工业固氮反应是:N2 (g)+3H2 (g)?2NH3(g)△H=-92.4kJ/mol.在相同温度下,体积均为0.25L的两个恒容密闭容器中可发生上述可逆反应,测得反应的有关数据如下:
①容器a达平衡时N2的平衡浓度c(N2)=3mol/L.
②容器b达平衡时NH3的平衡浓度c(NH3)=2mol/L.
③下列叙述正确的是AB.
A.容器a达平衡时NH3的物质的量是0.5mol
B.容器b开始是向合成氨的逆反应方向进行
C.若容器a体积变为0.2L,则达平衡时放出的热量小于23.1kJ
D.不能利用已知数据计算容器b的平衡常数
(3)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(1)?4NH3(g)+3O2(g),则其反应热△H=+1530 kJ•mol-1.
(已知:N2 (g)+3H2 (g)?2NH3(g)△H=-92.4kJ•mol-1
2H2(g)+O2(g)?2H2O(l)△H=-571.6kJ•mol-1)
(1)下表列举了不同温度下大气固氮的部分K值.
| 反应 | 大气固氮 N2(g)+O2(g)?2NO(g) | |
| 温度/℃ | 27 | 2000 |
| K | 3.84×10-31 | 0.1 |
②分析数据可知:人类不适合大规模模拟大气固氮的原因K值小,正向进行的程度小(或转化率低),不适合大规模生产.
(2)工业固氮反应是:N2 (g)+3H2 (g)?2NH3(g)△H=-92.4kJ/mol.在相同温度下,体积均为0.25L的两个恒容密闭容器中可发生上述可逆反应,测得反应的有关数据如下:
| 容器 编号 | 起始时各物质物质的量/mol | 达平衡时体系的 能量变化 | ||
| N2 | H2 | NH3 | ||
| a | 1 | 3 | 0 | 放热23.1kJ |
| b | 0.6 | 1.8 | 0.8 | 吸热Q kJ |
②容器b达平衡时NH3的平衡浓度c(NH3)=2mol/L.
③下列叙述正确的是AB.
A.容器a达平衡时NH3的物质的量是0.5mol
B.容器b开始是向合成氨的逆反应方向进行
C.若容器a体积变为0.2L,则达平衡时放出的热量小于23.1kJ
D.不能利用已知数据计算容器b的平衡常数
(3)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(1)?4NH3(g)+3O2(g),则其反应热△H=+1530 kJ•mol-1.
(已知:N2 (g)+3H2 (g)?2NH3(g)△H=-92.4kJ•mol-1
2H2(g)+O2(g)?2H2O(l)△H=-571.6kJ•mol-1)