题目内容
2.下列溶液中微粒的物质的量浓度关系正确的是( )| A. | 已知H2C2O4为二元弱酸,则Na2C2O4溶液:c(OH- )=c(H+ )+c(H2C2O4-)+c(H2C2O4) | |
| B. | 等体积、等物质的量浓度的NaX和弱酸HX混合:c(Na+)=c(X-)>c(OH-)=c(H+) | |
| C. | 常温下,将25mL0.2mol/L的盐酸与100mL0.1mol/L的氨水混合,所得溶液中:c(Cl-)>c(NH4+)>c(NH3•H2O)>c(OH-)>c(H+) | |
| D. | 将0.1mol/L的Na2S溶液与0.1mol/L的NaHS溶液等体积混合,所得溶液中:2c(S2-)+c(OH-)+c(HS-)=c(H+)+c(Na+) |
分析 A.根据草酸溶液中的质子守恒判断;
B.混合液不一定显示中性,需要根据HX的电离程度与X-的水解程度大小进行判断;
C.反应后溶液中的溶质为等浓度的氯化铵和一水合氨,一水合氨的电离程度大于铵根离子的水解程度,混合液呈碱性,则c(OH-)>c(H+),根据电荷守恒可知:c(NH4+)>c(Cl-);
D.混合液中一定满足电荷守恒,根据电荷守恒判断.
解答 解:A.已知H2C2O4为二元弱酸,根据Na2C2O4溶液中的质子守恒可得:c(OH- )=c(H+ )+c(H2C2O4-)+2c(H2C2O4),故A错误;
B.等体积、等物质的量浓度的NaX和弱酸HX混合,需要根据HX的电离程度与X-的水解程度大小判断溶液酸碱性,若HX的电离程度大于X-的水解程度,则混合液层酸性,c(OH-)<c(H+),若HX的电离程度小于X-的水解程度,则溶液呈碱性,则c(OH-)>c(H+),故B错误;
C.常温下,将25mL0.2mol/L的盐酸与100mL0.1mol/L的氨水混合,混合液中溶质为等浓度的氯化铵和一水合氨,一水合氨的电离程度大于铵根离子的水解程度,混合液呈碱性,则c(OH-)>c(H+),根据电荷守恒可知:c(NH4+)>c(Cl-),根据物料守恒可知:c(NH4+)>c(Cl-)>c(NH3•H2O),溶液中各离子浓度大小为:c(NH4+)>c(Cl-)>c(NH3•H2O)>c(OH-)>c(H+),故C错误;
D.0.1mol/L的Na2S溶液与0.1mol/L的NaHS溶液等体积混合,根据电荷守恒可知:2c(S2-)+c(OH-)+c(HS-)=c(H+)+c(Na+),故D正确;
故选D.
点评 本题考查了离子浓度大小比较,题目难度中等,明确反应后溶质组成及盐的水解原理为解答关键,注意掌握物料守恒、电荷守恒、质子守恒的含义,能够根据盐的水解原理及各种守恒关系正确判断溶液中各离子浓度大小.

| A. | CH4 C2H4 | B. | CH4 C3H6 | C. | C2H6 C3H4 | D. | C2H2 C3H6 |
①四氯化碳②苯③溴苯④植物油⑤乙醇⑥乙酸乙酯⑦乙酸.
| A. | ②④⑥ | B. | ①②③④⑤ | C. | ④⑥ | D. | ①②③ |
| A. | 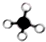 甲烷 | B. | 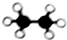 乙烷 | C. | 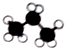 丙烷 | D. | 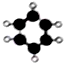 苯 |
| A. | 纤维素、蛋白质都是有机高分子化合物 | |
| B. | 苯、甲苯等是煤的主要成分 | |
| C. | 花生油、牛油都是酯类 | |
| D. | 豆浆、牛奶可作为误食重金属盐的解毒剂 |
| A. | 过氧化钠的电子式: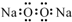 | |
| B. | “玉兔”号月球车上使用的质子数94,中子数144的钚原子:${\;}_{94}^{144}$Pu | |
| C. | CH4的球棍模型: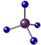 | |
| D. | Na的原子结构示意图: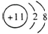 |