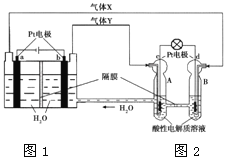
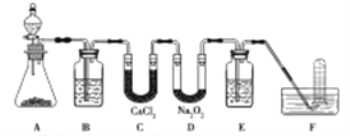
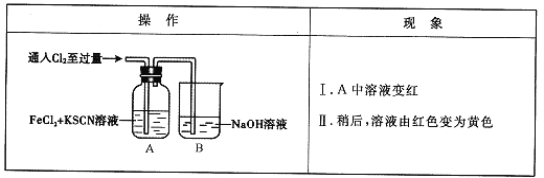
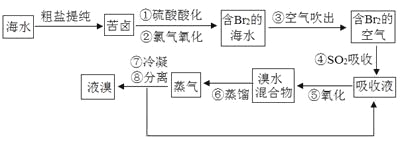
题目内容
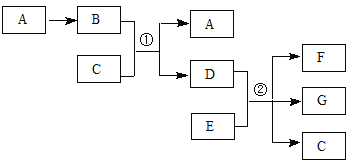
【题目】下列各物质转化关系如图所示,气体B为红棕色,C常温时为无色液体,相对分子质量D比B大17,E的原子序数为12。
回答下列问题:
(1)A的化学式是 ,C分子的电子式是 。
(2)反应①的离子方程式是 ;若n(E)∶n(D)=2∶5,反应②的化学方程式是 。
【答案】(1)NO ;![]()
(2)3NO2+H2O=2H++2NO3-+NO
4Mg+10HNO3=4 Mg(NO3)2+N2O↑+ 5H2O或4Mg+10HNO3=4 Mg(NO3)2+NH4NO3+3H2O
【解析】
试题分析:A能生成B,气体B为红棕色,C常温时为无色液体,B与C反应生成A与D,相对分子质量D比B大17,则A为NO,B为NO2,C为H2O,D为HNO3,E的原子序数为12,则E为Mg。
(1)根据上述推断,A为一氧化氮,化学式为NO;C为水,水是共价化合物,电子式为![]() 。
。
(2)反应①是二氧化氮与水反应生成硝酸和NO,反应的离子方程式为3NO2 +H2O=2H++2NO3-+ NO;若n(E)∶n(D)=2∶5,设镁的物质的量为2mol,则硝酸的物质的量为5mol,2molMg失去4mol电子,生成2mol硝酸镁[Mg(NO3)2],起酸性作用的硝酸为4mol,根据氮原子守恒,得电子的硝酸是1mol,根据得失电子守恒,1molHNO3得4mol电子生成+1价氮的化合物,所以反应②的化学方程式是4Mg+10HNO3=4 Mg(NO3)2+N2O↑+ 5H2O。

练习册系列答案
相关题目