题目内容
下图烧杯中盛有稀硫酸,则:
(1)A中进行的离子反应方程式为 。
(2)B中各电极的电极反应式:负极: ;正极: 。
(3)C中被腐蚀的金属是 ,正极反应 。
(4)三烧杯中铁被腐蚀的速率由快到慢的顺序是 。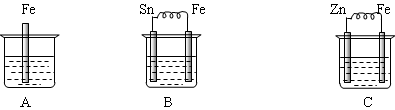
(1)A中进行的离子反应方程式为 。
(2)B中各电极的电极反应式:负极: ;正极: 。
(3)C中被腐蚀的金属是 ,正极反应 。
(4)三烧杯中铁被腐蚀的速率由快到慢的顺序是 。

(12分)每小题2分
(1)Fe+2H+==Fe2++H2↑
(2)Fe-2e-==Fe2+; 2H++2e-==H2↑
(3)Zn; 2H++2e-==H2↑
(4)B>A > C
(1)Fe+2H+==Fe2++H2↑
(2)Fe-2e-==Fe2+; 2H++2e-==H2↑
(3)Zn; 2H++2e-==H2↑
(4)B>A > C
试题分析:(1)铁是活泼的金属,很容易的置换出酸中的氢,离子方程式为Fe+2H+==Fe2++H2↑。
(2)Fe的活泼性大于Sn的活泼性,Fe为负极,失去电子,发生氧化反应,电极反应式为Fe-2e-==Fe2+,Sn为正极,电极反应式为2H++2e-==H2↑。
(3)Zn的活泼性大于Fe的活泼性,Zn是负极,失去电子,发生氧化反应,故被溶解的金属是Zn。正极反应式为2H++2e-==H2↑。
(4)金属腐蚀的程度为:在原电池中做负极的腐蚀程度最大,发生化学反应的次之,做正极的腐蚀的最弱,故三烧杯中铁被腐蚀的速率由快到慢的顺序是B>A > C。
点评:本题考查的是原电池的工作原理,题目难度中,在原电池中,一般活泼金属做负极,不活泼金属或惰性电极或碳棒做正极,负极的活泼性大于正极的活泼性。负极质量减少,正极质量增加或有气泡冒出。电子由负极流向正极,电流由正极流向负极。

练习册系列答案
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案
相关题目