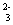题目内容
理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应“Cu+2Ag+ =2 Ag +Cu2+ ”设制一个化学电池(正极材料用碳棒),回答下列问题:
该电池的电解质溶液是 ;负极发生 反应(填“氧化”或“还原”),电极反应式
该电池的电解质溶液是 ;负极发生 反应(填“氧化”或“还原”),电极反应式
(1)硝酸银 ,氧化反应, Cu -2e-=Cu2+
试题分析:原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应,据此可知铜是负极,失去电子,凡是氧化反应,电极反应式是Cu -2e-=Cu2+。银离子在正极得到电子,因此电解质溶液应该是硝酸银溶液。
点评:该题是高考中的常见题型,属于基础性试题的考查。试题难易适中,基础性强,侧重考查学生灵活运用原电池原理解决实际问题的能力,有利于提高学生的逻辑推理能力和学习效率。该题的关键是明确原电池的工作原理,然后结合题意灵活运用即可。

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
相关题目
 +7H2O
+7H2O