题目内容
15.25℃时,下列分子或离子在指定的分散系中能大量共存的一组是( )| A. | 空气 SO2、NO、NO2、CO | |
| B. | 碱性溶液 Na+、K+、NO3-、CO32- | |
| C. | 酸性溶液 Na+、ClO-、SO42-、SiO32- | |
| D. | KNO3溶液 Fe2+、H+、Cl-、Cu2+ |
分析 A.NO易被氧化;
B.该组离子之间不反应;
C.离子之间结合生成沉淀、弱电解质;
D.离子之间发生氧化还原反应.
解答 解:A.空气中的氧气与NO反应生成NO2,不能共存,故A不选;
B.碱性溶液中该组离子之间不反应,可大量共存,故B选;
C.酸性溶液,H+、ClO-结合生成HClO,H+、SiO32-结合生成H2SiO3沉淀,不能共存,故C不选;
D.在酸性溶液中NO3-氧化Fe2+,不能共存,故D不选;
故选B.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重氧化还原反应、复分解反应的离子共存考查,题目难度不大.

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案
相关题目
6.下列实验操作、现象和结论均正确的是( )


| 选项 | 操作 | 现象 | 结论 |
| A | ①将湿润的红色石蕊试纸靠近试管口 | 试纸不变色 | NH4Cl受热不分解 |
| B | ②将铜丝向下移动使其与浓硝酸接触 | 产生红棕色气体,用排水法收集气体 | 可以用该装置制备NO2 |
| C | ③光照 | 试管颜色变浅,出现油状滴液,少量白雾 | 甲烷与氯水发生取代反应 |
| D | 打开分液漏斗 | 右侧试管中出现白色沉淀 | 酸性:HNO3>H2CO3>H2SiO3 |
| A. | A | B. | B | C. | C | D. | D |
20.X、Y、Z、M、Q是中学化学常见的五种元素,原子序数依次增大,其结构或性质信息如下表
(1)Q元素基态原子的电子排布式是1s22s22p63s23p63d64s2.
(2)比较Y元素与氧元素的第一电离能N>O;X和Z形成的化合物XZ2为一种液体溶剂,其分子中的σ键和π键数目之比为1:1.
(3)写出实验室制备M单质的离子方程式MnO2+2Cl-+4H+$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+Mn2++2H2O.
(4)M的气态氢化物和氟化氢相比(写化学式)
稳定性强的是HF,其原因是因为元素非金属性F>Cl,所以HF稳定;
沸点高的是HF,其原因是因为HF分子之间存在氢键,所以HF沸点高.
| 元素 | 结构或性质信息 |
| X | 其原子最外层电子数是内层电子数的2倍 |
| Y | 基态原子最外层电子排布为nsnnpn+1 |
| Z | 非金属元素,其单质为固体,在氧气中燃烧时有明亮的蓝紫色火焰 |
| M | 单质在常温、常压下是气体.基态原子的M层上有1个未成对的p电子 |
| Q | 其与X形成的合金为目前用量最多的金属材料 |
(2)比较Y元素与氧元素的第一电离能N>O;X和Z形成的化合物XZ2为一种液体溶剂,其分子中的σ键和π键数目之比为1:1.
(3)写出实验室制备M单质的离子方程式MnO2+2Cl-+4H+$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+Mn2++2H2O.
(4)M的气态氢化物和氟化氢相比(写化学式)
稳定性强的是HF,其原因是因为元素非金属性F>Cl,所以HF稳定;
沸点高的是HF,其原因是因为HF分子之间存在氢键,所以HF沸点高.
7.氮的固定是几百年来科学家一直研究的课题.
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值.
①分析数据可知:大气固氮反应属于吸热(填“吸热”或“放热”)反应.
②分析数据可知:人类不适合大规模模拟大气固氮的原因K值小,正向进行的程度小(或转化率低),不适合大规模生产.
③从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因从反应速率角度考虑,高温更好,但从催化剂活性等综合因素考虑选择500℃左右合适.
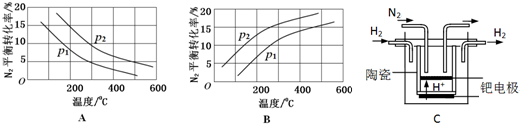
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(р1、р2)下随温度变化的曲线,下图所示的图示中,正确的是A(填“A”或“B”);比较р1、р2的大小关系р2>р1.
(3)20世纪末,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现高温常压下的电化学合成氨,提高了反应物的转化率,其实验简图如C所示,阴极的电极反应式是N2+6e-+6H+=2NH3.
(4)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O?4NH3(g)+3O2(g),则其反应热△H=+1530 kJ•mol-1.
(已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,2H2(g)+O2(g)?2H2O(l)△H=-571.6kJ•mol-1)
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值.
| 反应 | 大气固氮 N2(g)+O2(g)?2NO(g) | 工业固氮 N2(g)+3H2(g)?2NH3(g) | |||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
②分析数据可知:人类不适合大规模模拟大气固氮的原因K值小,正向进行的程度小(或转化率低),不适合大规模生产.
③从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因从反应速率角度考虑,高温更好,但从催化剂活性等综合因素考虑选择500℃左右合适.
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(р1、р2)下随温度变化的曲线,下图所示的图示中,正确的是A(填“A”或“B”);比较р1、р2的大小关系р2>р1.
(3)20世纪末,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现高温常压下的电化学合成氨,提高了反应物的转化率,其实验简图如C所示,阴极的电极反应式是N2+6e-+6H+=2NH3.
(4)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O?4NH3(g)+3O2(g),则其反应热△H=+1530 kJ•mol-1.
(已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,2H2(g)+O2(g)?2H2O(l)△H=-571.6kJ•mol-1)

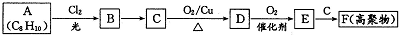
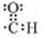 ;E一→F反应类型为缩聚反应.
;E一→F反应类型为缩聚反应. .
.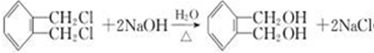 .
.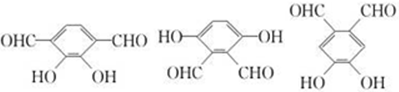 (2种即可).
(2种即可).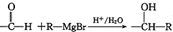 现发生反应D+G$\stackrel{H+/H_{2}O}{→}$H$→_{△}^{浓H_{2}SO_{4}}$J(
现发生反应D+G$\stackrel{H+/H_{2}O}{→}$H$→_{△}^{浓H_{2}SO_{4}}$J( ),则
),则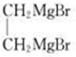 ,
,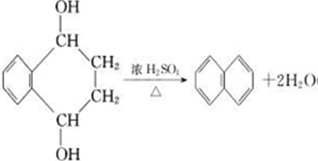 .
.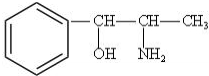 构简式如右图所示,其合成路线如下:A$→_{①}^{Cl_{2}}$B$→_{②}^{NaOH溶液/△}$C$→_{③}^{Cu/△}$D$→_{④}^{E}$F$→_{⑤}^{Fe、HCl}$PPA,其中A~F分别代表一种有机化合物,合成路线中部分产物及反应条件已略去.已知:
构简式如右图所示,其合成路线如下:A$→_{①}^{Cl_{2}}$B$→_{②}^{NaOH溶液/△}$C$→_{③}^{Cu/△}$D$→_{④}^{E}$F$→_{⑤}^{Fe、HCl}$PPA,其中A~F分别代表一种有机化合物,合成路线中部分产物及反应条件已略去.已知: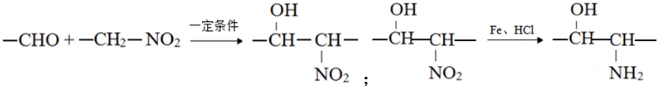
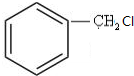 +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$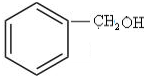 +NaCl.
+NaCl.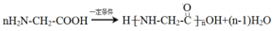 .
.