题目内容
【题目】下列变化化学键未被破坏的是( )
A.HCl溶于水B.NaOH固体熔化
C.NH4HCO3分解D.碘升华
【答案】D
【解析】
A.HCl溶于水,断裂共价键,产生H+、Cl-,A不符合题意;
B.NaOH固体熔化,断裂离子键,产生Na+、OH-,B不符合题意;
C.NH4HCO3分解产生NH3、H2O、CO2,断裂离子键、共价键,C不符合题意;
D.碘是由I2分子构成的分子晶体,升华时破坏的是分子间作用力,而分子内的共价键没有被破坏,D符合题意;
故合理选项是D。

【题目】无水四氯化锡(SnCl4)常用作有机合成的氯化催化剂。实验室可用熔融的锡(熔点231.9℃)与Cl2反应制备SnCl4,装置如下图所示。
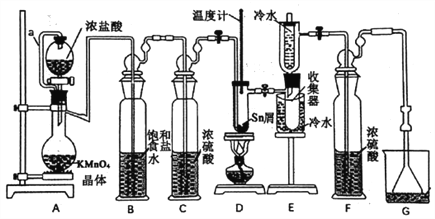
已知:①SnCl2、SnCl4有关物理性质如下表
物质 | 颜色、状态 | 熔点/℃ | 沸点/℃ |
SnCl2 | 无色晶体 | 246 | 652 |
SnCl4 | 无色液体 | -33 | 114 |
②SnCl4在空气中极易水解生成SnO2·xH2O。
回答下列问题:
(1)导管a的作用是____________,装置A中发生反应的离子方程式为___________。
(2)当观察到装置F液面上方出现___________现象时才开始点燃酒精灯,待锡熔化后适当增大氯气流量,继续加热。此时继续加热的目的是___________、___________。
(3)若上述装置中缺少装置C(其它均相同),则D处具支试管中发生的主要副反应化学方程式为___________ 。
(4)若制得产品中含有少量Cl2,则可采用下列___________(填字母)措施加以除去。
A.加入NaOH萃取分液 B.加入足量锡再加热蒸馏
C.加入碘化钾冷凝过滤 D.加入饱和食盐水萃取
(5)可用碘量法测定最后产品的纯度,发生如下反应:Sn2++I2=Sn4++2Iˉ。准确称取该样品m g放于锥形瓶中,用少量浓盐酸溶解,再加水稀释,淀粉溶液作指示剂,用0.1mol·L-1碘标准溶液滴定至终点,消耗标准液20.00mL,则产品中SnCl2的含量为___________(用含m的代数式表示);即使此法测定的操作均正确,但测得的SnCl4含量仍高于实际含量,其原因可能是___________(用离子方程式表示)。