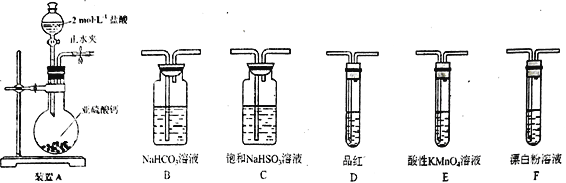
题目内容
【题目】图1是元素周期表的一部分,已知A、B、C、D、E、F、G都是周期表中的前四周期元素,它们在周期表中的位置如图1所示。
试回答下列问题:
(1)F元素基态原子的核外电子排布式为_________________。
(2)ABC的第一电离能由大到小的顺序______________(用元素符号表示)。
(3)B元素单质分子中的_______个π键,与其互为等电子体的阴离子为____________________。
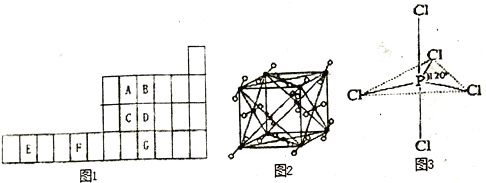
(4)图2为A元素某种氧化物的晶胞,其分子中心原子采用________杂化,每个分子周围有_____个分子与之距离相等且最近。若晶胞棱长为apm,则该晶体密度的表达式为________g·cm-3。
(5)G元素的氢化物分子的空间构型为________,其沸点与B元素的氢化物相比________ (填高或低),其原因是________ 。
(6)向CuSO4溶液中滴加入B元素氢化物的水溶液,先生成蓝色沉淀,后沉淀逐渐溶解,得到深蓝色透明溶液,请写出沉淀溶解的离子方程式________ 。
(7)知道B的电负性大于氯,则B与F2或Cl2形成的化合物水解,产物是否相同__________?(填“相同”或“不同”)。
【答案】 1s22s22p63s23p63d104s1 N>C>Si 2 CN sp 12 ![]() 176/[NA×(a×10-10)3] 三角锥形 低 NH3分子之间存在氢键 Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2++2OH-+4H2O 不同
176/[NA×(a×10-10)3] 三角锥形 低 NH3分子之间存在氢键 Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2++2OH-+4H2O 不同
【解析】(1)F的原子序数为29,是铜元素,其核外电子排布式为1s22s22p63s23p63d104s1。
(2)A、B、C元素分别为碳、氮、硅元素,碳与硅同一主族,碳的第一电离能大于硅的第一电离能,N的2p轨道是半充满结构,属于稳定结构,故氮的第一电离能大于碳的第一电离能,所以第一电离能由大到小的顺序为N>C>Si。
(3)N2分子中是氮氮叁键,含有2个π键;等电子体是原子个数相同、电子总数也相同的粒子间的互称,N2含有14个电子,故与其为等电子体的阴离子为CN-或者C22-。
(4)A为碳元素,根据图示可知该分子为CO2,CO2为直线型分子,中心碳原子采取sp杂化;以顶角的CO2为标准,与它最近的CO2分子位于面心,共有12个;一个晶胞中实际含有的CO2分子个数为8×1/8+6×1/2=4,晶包的体积为(a×10-10)3cm3,所以晶体的密度=44÷NA×4÷(a×10-10)3=176/【NA×(a×10-10)3】g·cm-3。
(5)G为As元素,氢化物为AsH3,分子空间构型与NH3相同,为三角锥形;氨气分子间可以形成氢键,AsH3分子间只有分子间作用力,所以AsH3的沸点低于NH3的沸点。故答案为:三角锥、低、NH3分子之间存在氢键。
(6)CuSO4溶液中加入氨气水溶液,先生成Cu(OH)2沉淀,Cu(OH)2的Cu离子有4个空轨道,而氨气分子中的N原子有未成对电子,故两者可以形成配位键,从而Cu(OH)2溶解在氨水中,离子方程式为:Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2++2OH-+4H2O。
(7)N元素的电负性小于F的,所以NF3中N为+3价,F为-1价,与水的水解反应即复分解反应,水解产物为HF和HNO2;N的电负性大于Cl的电负性,所以在NCl3中,N为-3价,Cl为+1价,水解的产物为NH3和HClO,故两者水解的产物不同。

【题目】CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿[主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等]制取CoCl2·6H2O的工艺流程如下:
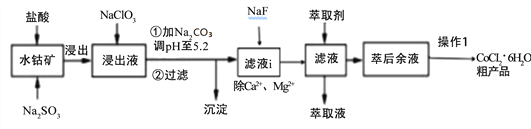
已知:①浸出液含有的阳离子主要有H+、Co2+、Ca2+、Mg2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
③CoCl26H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴。
(1)写出浸出过程中Co2O3发生反应的离子方式_______________________________。
(2)NaClO3的作用是____________________写出该反应的离子方程式_____________;
若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体是 ___________(填化学式)。
(3)加Na2CO3调pH至5.2所得沉淀为________________。
(4)萃取剂对金属离子的萃取率与pH的关系如下图。加萃取剂的目的是_______________;其使用的最佳pH范围是(填字母代号)__________。
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
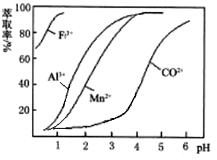
(5)操作I包含3个基本实验操作是蒸发、结晶和过滤.制得的CoCl26H2O需减压烘干的原因是______________________________。
(6)除“钙”“镁”是将滤液i中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知某温度下,Ksp(MgF2)=7.35×10-11,Ksp(CaF2)=1.50×10-10。当加入过量NaF,所得滤液中c(Mg2+)/c(Ca2+)=_____________。