题目内容
【题目】无水四氯化锡(SnCl4)常用作有机合成的氯化催化剂。实验室可用熔融的锡(熔点231.9℃)与Cl2反应制备SnCl4,装置如下图所示。
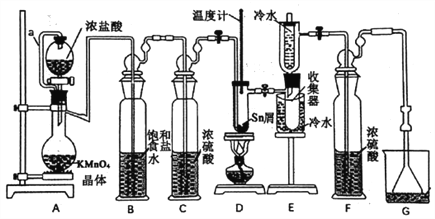
已知:①SnCl2、SnCl4有关物理性质如下表
物质 | 颜色、状态 | 熔点/℃ | 沸点/℃ |
SnCl2 | 无色晶体 | 246 | 652 |
SnCl4 | 无色液体 | -33 | 114 |
②SnCl4在空气中极易水解生成SnO2·xH2O。
回答下列问题:
(1)导管a的作用是____________,装置A中发生反应的离子方程式为___________。
(2)当观察到装置F液面上方出现___________现象时才开始点燃酒精灯,待锡熔化后适当增大氯气流量,继续加热。此时继续加热的目的是___________、___________。
(3)若上述装置中缺少装置C(其它均相同),则D处具支试管中发生的主要副反应化学方程式为___________ 。
(4)若制得产品中含有少量Cl2,则可采用下列___________(填字母)措施加以除去。
A.加入NaOH萃取分液 B.加入足量锡再加热蒸馏
C.加入碘化钾冷凝过滤 D.加入饱和食盐水萃取
(5)可用碘量法测定最后产品的纯度,发生如下反应:Sn2++I2=Sn4++2Iˉ。准确称取该样品m g放于锥形瓶中,用少量浓盐酸溶解,再加水稀释,淀粉溶液作指示剂,用0.1mol·L-1碘标准溶液滴定至终点,消耗标准液20.00mL,则产品中SnCl2的含量为___________(用含m的代数式表示);即使此法测定的操作均正确,但测得的SnCl4含量仍高于实际含量,其原因可能是___________(用离子方程式表示)。
【答案】 使分液漏斗内的液体顺利流下 2MnO4-+16H++10C1-=2Mn2++5Cl2↑+8H2O 黄绿色气体时 加快氯气与锡反应 使SnC14气化,利于从混合物中分离出来 SnC14+(x+2)H2O=SnO2·xH2O+4HCl B 38/m% 4I-+O2+4H+=2I2+2H2O
【解析】试题分析:本题考查SnCl4的制备,侧重Cl2的实验室制法,产品的提纯,滴定实验和误差分析。
(1)导管a将分液漏斗与蒸馏烧瓶连接,作用是:平衡压强,使分液漏斗内的液体顺利流下。装置A中KMnO4晶体与浓盐酸反应生成KCl、MnCl2、Cl2和H2O,反应的化学方程式为:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,反应的离子方程式为:2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O。
(2)由于Sn与空气中的O2反应、SnCl4在空气中极易水解生成SnO2·xH2O,所以制备SnCl4之前用Cl2排尽装置中的空气,观察到装置F液面上方出现黄绿色气体时,表明装置中空气已排尽,开始点燃D处的酒精灯。待Sn熔化后适当增大Cl2流量,继续加热,可加快Cl2与Sn反应的速率,同时使SnCl4气化,利于从混合物中分离出来(根据表中提供的SnCl4、SnCl2的熔沸点分析),在收集器中收集SnCl4。
(3)装置A制得的Cl2中混有HCl和H2O(g),装置B中饱和食盐水的作用是:除去Cl2中的HCl,装置C中浓硫酸的作用是:干燥Cl2;若上述装置中缺少装置C,Cl2中混有H2O(g),根据题给已知②“SnCl4在空气中极易水解生成SnO2·xH2O”,D处具支试管中发生的主要副反应为SnCl4+(x+2)H2O=SnO2·xH2O+4HCl。
(4)A,NaOH不仅吸收Cl2,而且能与SnCl4反应,不能采用;B,加入足量锡与Cl2反应,再加热蒸馏,能采用;C,碘化钾与Cl2反应生成KCl和I2,产品中混有I2,不能采用;D,加入饱和食盐水,不能吸收Cl2,SnCl4水解成SnO2·xH2O,不能采用;答案选B。
(5)根据Sn2++I2=Sn4++2I-,n(SnCl2)=n(I2)=0.1mol/L![]() 0.02L=0.002mol,m(SnCl2)=0.002mol
0.02L=0.002mol,m(SnCl2)=0.002mol![]() 190g/mol=0.38g,产品中SnCl2的含量为
190g/mol=0.38g,产品中SnCl2的含量为![]() 100%=38/m%。即使此法测定的操作均正确,但测得的SnCl4含量高于实际含量,其可能原因是I-被空气中O2氧化成I2,使消耗的碘标准溶液体积偏小,产品中SnCl2含量偏小,SnCl4含量偏高,反应的离子方程式为4I-+4H++O2=2I2+2H2O。
100%=38/m%。即使此法测定的操作均正确,但测得的SnCl4含量高于实际含量,其可能原因是I-被空气中O2氧化成I2,使消耗的碘标准溶液体积偏小,产品中SnCl2含量偏小,SnCl4含量偏高,反应的离子方程式为4I-+4H++O2=2I2+2H2O。

 名校课堂系列答案
名校课堂系列答案
