题目内容
【题目】将51.2gCu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物共0.6mol,这些气体恰好能被500mL 2mol/LNaOH溶液完全吸收,生成含NaNO3和NaNO2的盐溶液,其中NaNO3的物质的量为( )
A.0.2mol
B.0.6mol
C.0.8mol
D.1.0mol
【答案】A
【解析】解:用终态分析法容易看出只有两种元素的价态有变化,其一是Cu→Cu(NO3)2 , Cu元素化合价由0价升高为+2价,每个Cu原子失2个电子;另一个是HNO3→NaNO2 , N元素由+5价降低为+3价,每个N原子得2个电子,51.2gCu共失电子为 ![]() ×2=1.6mol,HNO3到NaNO2共得到电子1.6mol,故产物中NaNO2的物质的量为
×2=1.6mol,HNO3到NaNO2共得到电子1.6mol,故产物中NaNO2的物质的量为 ![]() =0.8mol,由Na守恒可知n(NaOH)=n(NaNO2)+n(NaNO3),所以n(NaNO3)=n(NaOH)﹣n(NaNO2)=0.5L×2mol/L﹣0.8mol=0.2mol.故选:A.
=0.8mol,由Na守恒可知n(NaOH)=n(NaNO2)+n(NaNO3),所以n(NaNO3)=n(NaOH)﹣n(NaNO2)=0.5L×2mol/L﹣0.8mol=0.2mol.故选:A.

【题目】保持营养平衡,合理使用药物是保证身心健康、提高生活质量的有效手段.
(1)氨基酸是组成蛋白质的基本结构单元,其分子中一定含有的官能团是氨基(﹣NH2)和 (写结构简式).
(2)发育出现障碍,患营养缺乏症,这主要是由于摄取 (填“蛋白质”“脂肪”或“糖类”)不足引起的.下列食物中富含该物质的是 (填字母).
A.菠菜B.花生油 C.瘦肉D.西瓜
(3)如图所示4支试管同时水浴加热4min,为检验其中淀粉的水解程度,某同学的实验操作与现象记录如下:
编号 | 操作 | 现象 |
1 | 加入碘水 | 溶液变成蓝色 |
2 | 加入银氨溶液,水浴加热 | 未出现银镜 |
3 | 加入碘水 | 溶液变成蓝色 |
4 | 加入银氨溶液,水浴加热 | 未出现银镜 |
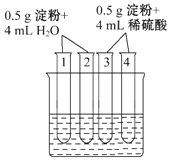
结合试管1、2中的现象,得出的结论是这两支试管中淀粉 水解(填“没有”“部分”或“全部”).结合试管3、4中的现象,不能得出“这两支试管中淀粉没有水解”的结论,理由是