题目内容
【题目】TiO2在工业生产和日常生活中有重要用途.
(1)工业上用钛铁矿石(FeTiO3 , 含FeO、Al2O3、SiO2等杂质)经过下述反应制得: 
其中,步骤③发生的反应为:2H2SO4+FeTiO3=TiOSO4+FeSO4+2H2O.
(i)净化钛矿石时,需用浓氢氧化钠溶液来处理,写出该过程中两性氧化物发生反应的离子反应方程式: .
(ii)④中加入的X可能是
A.H2O2 B.KMnO4 C.KOH D.SO2
(iii)④⑤两步的目的是 .
(iv)写出⑥的化学反应方程式 .
(2)TiO2可通过下述两种方法制备金属钛:方法一是先将TiO2与Cl2、C反应得到TiCl4 , 再用镁还原得到Ti.
(i)写出生成TiCl4的化学反应方程式
方法二是电解TiO2来获得Ti(同时产生O2):
将处理过的TiO2作阴极,石墨为阳极,熔融CaO为电解液,用碳块作电解槽池.
(ii)阴极反应的电极反应式为 .
(iii)电解过程中需定期向电解槽池中加入碳块的原因是 .
【答案】
(1)Al2O3+2OH﹣=2AlO2﹣+H2O;A;除去亚铁离子;TiOSO4+3H2O=TiO22H2O↓+H2SO4
(2)TiO2+Cl2+C=TiCl4+CO2或TiO2+Cl2+2C=TiCl4+2CO;TiO2+4e﹣=Ti+2O2﹣(或Ti4++4e﹣=Ti);碳单质会与阳极产生的氧气反应而不断减少
【解析】解:钛铁矿石粉碎、净化,净化时加入浓NaOH溶液,发生的反应为Al2O3+2OH﹣=2AlO2﹣+H2O、SiO2+2OH﹣=SiO32﹣+H2O;
然后向钛铁矿石中加入过量80%硫酸并加热至343K﹣353K,发生反应2H2SO4+FeTiO3=TiOSO4+FeSO4+2H2O,FeO和硫酸反应生成FeSO4 , 加入X并调节溶液的pH得到沉淀和TiO2+、SO42﹣ , 说明加入X后将亚铁离子氧化为铁离子然后调节溶液pH值将铁离子沉淀,
然后将TiO2+、SO42﹣加热、过滤得到TiO2.2H2O,焙烧得到TiO2;(1)两性氧化物是氧化铝,和NaOH溶液反应生成盐和水,离子反应方程式为Al2O3+2OH﹣=2AlO2﹣+H2O,
故答案为:Al2O3+2OH﹣=2AlO2﹣+H2O;(2)④X应该具有强氧化性,且不能引进杂质,具有氧化性的是双氧水和高锰酸钾溶液,但高锰酸钾溶液氧化亚铁离子时引进新的杂质,故选A;(3)④⑤两步的目的是除去亚铁离子,防止制得的二氧化钛中含有杂质,故答案为:除去亚铁离子;(4)⑥中TiO2+水解生成TiO2.2H2O,反应方程式为TiOSO4+3H2O=TiO22H2O↓+H2SO4 ,
故答案为:TiOSO4+3H2O=TiO22H2O↓+H2SO4;(5)TiO2与Cl2、C反应得到TiCl4 , 同时生成二氧化碳或CO,再用镁还原得到Ti和氯化镁,则生成四氯化钛的反应方程式为TiO2+Cl2+C=TiCl4+CO2或TiO2+Cl2+2C=TiCl4+2CO,
故答案为:TiO2+Cl2+C=TiCl4+CO2或TiO2+Cl2+2C=TiCl4+2CO;(6)阴极上得电子反应还原反应生成金属钛,电极反应式为TiO2+4e﹣=Ti+2O2﹣(或Ti4++4e﹣=Ti),
故答案为:TiO2+4e﹣=Ti+2O2﹣(或Ti4++4e﹣=Ti);(7)阳极上氧离子失电子生成氧气,氧气和C反应生成二氧化碳,所以需要定期补充碳,
故答案为:碳单质会与阳极产生的氧气反应而不断减少.
钛铁矿石粉碎、净化,净化时加入浓NaOH溶液,发生的反应为Al2O3+2OH﹣=2AlO2﹣+H2O、
SiO2+2OH﹣=SiO32﹣+H2O;
然后向钛铁矿石中加入过量80%硫酸并加热至343K﹣353K,发生反应2H2SO4+FeTiO3=TiOSO4+FeSO4+2H2O,FeO和硫酸反应生成FeSO4 , 加入X并调节溶液的pH得到沉淀和TiO2+、SO42﹣ , 说明加入X后将亚铁离子氧化为铁离子然后调节溶液pH值将铁离子沉淀,
然后将TiO2+、SO42﹣加热、过滤得到TiO2.2H2O,焙烧得到TiO2;(1)两性氧化物是氧化铝,和NaOH溶液反应生成盐和水;(2)④X应该具有强氧化性,且不能引进杂质;(3)④⑤两步的目的是除去亚铁离子;(4)⑥中TiO2+水解生成TiO2.2H2O;(5)TiO2与Cl2、C反应得到TiCl4 , 同时生成二氧化碳或CO,再用镁还原得到Ti和氯化镁;(6)阴极上得电子反应还原反应生成金属钛;(7)阳极上氧离子失电子生成氧气,氧气和C反应生成二氧化碳.

 手拉手全优练考卷系列答案
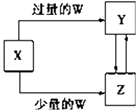
手拉手全优练考卷系列答案【题目】已知X,Y,Z,W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去).则W,X不可能是( )
选项 | W | X |
A | 稀硫酸 | NaAlO2溶液 |
B | 稀硝酸 | Fe |
C | CO2 | Ca(OH)2溶液 |
D | Cl2 | Fe |
A.A
B.B
C.C
D.D