题目内容
20.在25℃时建立下列平衡:2NO2?N2O4△H>0,若把烧瓶置于100℃的沸水中,下列各项:①颜色 ②平均摩尔质量 ③质量 ④压强 ⑤密度,其中不变的是( )| A. | ③⑤ | B. | ③④ | C. | ②④ | D. | ①③ |
分析 △H>0,升高温度化学平衡向着正反应方向移动.
解答 解:升高温度,化学平衡向着吸热方向进行,所以化学平衡2NO2?N2O4向左进行.
①化学平衡2NO2?N2O4向左进行,生成二氧化氮浓度增大,颜色加深,发生改变,故①错误;
②化学平衡2NO2?N2O4向左进行,质量守恒,所以总的物质的量增大了,所以平均摩尔质量要减小,会发生改变,故②错误;
③化学平衡2NO2?N2O4向左进行,但是气体的总质量是守恒的,所以质量不变,故③正确;
④化学平衡2NO2?N2O4向左进行,质量守恒,所以总的物质的量增大了,所以压强会发生改变,故④错误;
⑤化学平衡2NO2?N2O4向左进行,气体的总质量是守恒的,烧瓶的体积也是不变的,所以密度不变,故⑤正确;
故选A.
点评 本题考查学生温度对化学平衡的影响知识,注意化学反应中质量守恒,可以根据所学知识来回答,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为:3Zn+2K2FeO4+8H2O$?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
| A. | 放电时负极反应为:Zn-2e-+2OH--Zn(OH)2 | |
| B. | 放电时正极发生氧化反应 | |
| C. | 放电时每转移2mol电子,反应的锌的质量是65g | |
| D. | 放电时化学能转化为电能 |
8.Ra(镭)是原子序数最大的第ⅡA族元素,下列说法不正确的是( )
| A. | 原子半径是第ⅡA族中最大的 | B. | 遇冷水能剧烈反应 | ||
| C. | 位于第七周期 | D. | Ra(OH)2是两性氢氧化物 |
15.下列用来表示物质变化的化学用语中,正确的是( )
| A. | 钢铁发生电化学腐蚀的正极反应式:Fe-2e-=Fe2+ | |
| B. | HS-水解的离子方程式:HS-+H2O?S2-+H3O+ | |
| C. | CO32-水解的离子方程式:CO32-+2 H2O?H2CO3+2OH- | |
| D. | 用FeS为沉淀剂除去废水中的Hg2+:FeS(s)+Hg2+(aq)=HgS(s)+Fe2+(aq) |
5.二甲醚(CH3OCH3)是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上以CO和H2为原料生产二甲醚CH3OCH3的新工艺主要发生三个反应:
①CO(g)+2H2(g)?CH3OH(g)△H1=-Q1 kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-Q2 kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-Q3 kJ•mol-1
回答下列问题:
(1)新工艺的总反应3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)的热化学方程式为3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-(2Q1+Q2+Q3)kJ/mol.
(2)工业上一般在恒容密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH (g)△H.下表所列数据是该反应在不同温度下的化学平衡常数(Κ).
①由表中数据判断△H<0 (填“>”、“=”或“<”).能够说明某温度下该反应是平衡状态的是A、C.
A.体系的压强不变
B.密度不变
C.混合气体的相对分子质量不变
D.c(CO)=c(CH3OH)
②某温度下,将 2mol CO和 6mol H2 充入2L的密闭容器中,充分反应 10min后,达到平衡时测得c(CO)=0.2mol/L,计算此温度下的平衡常数K=2.04.
(3)工业生产是把水煤气中的混合气体经过处理后获得的较纯H2用于合成氨.合成氨反应原理为:N2(g)+3H2(g)$?_{催化剂}^{高温高压}$ 2NH3(g)△H=-92.4kJ•mol-1.实验室模拟化工生产,在恒容密闭容器中充入一定量N2和H2后,分别在不同实验条件下反应,N2浓度随时间变化如图1.请回答下列问题: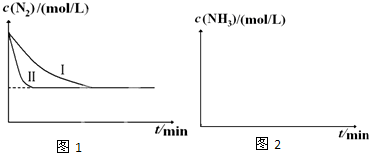
①与实验Ⅰ比较,实验Ⅱ改变的条件为加入催化剂.
②在实验Ⅲ中改变条件为采用比实验Ⅰ更高的温度,请在图2中画出实验Ⅰ和实验Ⅲ中c(NH3)随时间变化的示意图.
①CO(g)+2H2(g)?CH3OH(g)△H1=-Q1 kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-Q2 kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-Q3 kJ•mol-1
回答下列问题:
(1)新工艺的总反应3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)的热化学方程式为3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-(2Q1+Q2+Q3)kJ/mol.
(2)工业上一般在恒容密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH (g)△H.下表所列数据是该反应在不同温度下的化学平衡常数(Κ).
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
A.体系的压强不变
B.密度不变
C.混合气体的相对分子质量不变
D.c(CO)=c(CH3OH)
②某温度下,将 2mol CO和 6mol H2 充入2L的密闭容器中,充分反应 10min后,达到平衡时测得c(CO)=0.2mol/L,计算此温度下的平衡常数K=2.04.
(3)工业生产是把水煤气中的混合气体经过处理后获得的较纯H2用于合成氨.合成氨反应原理为:N2(g)+3H2(g)$?_{催化剂}^{高温高压}$ 2NH3(g)△H=-92.4kJ•mol-1.实验室模拟化工生产,在恒容密闭容器中充入一定量N2和H2后,分别在不同实验条件下反应,N2浓度随时间变化如图1.请回答下列问题:

①与实验Ⅰ比较,实验Ⅱ改变的条件为加入催化剂.
②在实验Ⅲ中改变条件为采用比实验Ⅰ更高的温度,请在图2中画出实验Ⅰ和实验Ⅲ中c(NH3)随时间变化的示意图.
12.下列元素的最高价氧化物溶于水,形成的含氧酸的酸性最强的是( )
| A. | 原子最外层电子数是次外层电子数2倍的元素 | |
| B. | 原子M层电子数等于L层和K层电子数之差的元素 | |
| C. | 第三周期ⅦA族的元素 | |
| D. | 最高正价和最低负价的绝对值之差为2的元素 |
9.将5.4g Al投入200.0mL 2.0mol•L-1的某溶液中有H2产生,充分反应后有金属剩余.该溶液可能为( )
| A. | HNO3溶液 | B. | NaOH溶液 | C. | H2SO4溶液 | D. | 盐酸 |
10.下列表示对应化学反应的离子方程式,其中正确的是( )
| A. | 苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32- | |
| B. | NaHSO4溶液中加入Ba(OH)2溶液至SO42完全沉淀:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| C. | (NH4)2Fe(SO4)2溶液中加入过量的氢氧化钡溶液:2NH4++Fe2++4OH-═Fe(OH)2↓+2NH3•H2O | |
| D. | 用惰性电极电解饱和氯化镁溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH- |
 .
. .
.