题目内容
【题目】在不同温度下,向 2 L密闭容器中加入1 mol NO(g)和1 mol活性炭(C),发生反应:2NO(g)+C(s) ![]() N2(g)+CO2(g) ΔH=-213.5 kJ·mol-1,达到平衡时的数据如下。
N2(g)+CO2(g) ΔH=-213.5 kJ·mol-1,达到平衡时的数据如下。
温度/℃ | n(C)/mol | n(CO2)/mol |
t1 | 0.70 | |
t2 | 0.25 |
下列说法不正确的是( )
A.上述信息可推知:t1<t2
B.t1℃ 时,该反应的平衡常数K=![]()
C.t2℃ 时,若反应达平衡后再缩小容器的容积,c(N2)∶c(NO)不变
D.t1℃ 时,若开始时反应物的用量均减小一半,平衡后NO的转化率减小
【答案】D
【解析】
A.温度t1时,平衡时消耗的n(活性炭)=1mol-0.7mol=0.3mol,则平衡时生成的n(CO2)=0.3mol,温度t
2时,生成的n(CO2)=0.25mol<0.3mol,平衡逆向移动,正反应为放热反应,升温平衡逆向移动,故温度t
1<t2,故A正确;
B.温度t
1时,活性炭的平衡物质的量为0.70mol,则消耗的n(活性炭)=1mol-0.7mol=0.3mol,故消耗的n(NO)=0.6mol,平衡时n(NO)=1mol-0.6mol=0.4mol,生成的n(N2)=0.3mol,生成的n(CO2)=0.3mol,反应气体气体体积不变,用物质的量代替浓度计算平衡常数,故K=![]() =
=![]() =
=![]() ,故B正确;
,故B正确;
C.平衡后再缩小容器的体积,压强增大,反应前后气体体积不变,平衡不移动,故c (N2):c (NO)不变,故C正确;
D.t
1℃时,若开始时反应物的用量均减小一半,等效为降低压强,反应前后气体体积不变,平衡不移动,NO的转化率不变,故D错误;
故答案为D。

【题目】A、B、C、D、E是中学化学中常见的四种短周期元素,有关位置及信息如下:
A的最高价氧化物对应的水化物与其氢化物反应生成离子化合物;C单质一般保存在煤油中;F单质是日常生活中用量最大的金属,易被腐蚀或损坏。
| E | A | B | ||
C |
| D |
请回答下列问题:
![]() 元素的氢化物水溶液能使酚酞变红的原因用电离方程式解释为 ______ 。
元素的氢化物水溶液能使酚酞变红的原因用电离方程式解释为 ______ 。
![]() 、D的氢化物相互反应,产生白色固体,鉴定该固体需用到的试剂或试纸
、D的氢化物相互反应,产生白色固体,鉴定该固体需用到的试剂或试纸![]() 蒸馏水除外
蒸馏水除外![]() 有 ______ 。
有 ______ 。
![]() 、C组成的某种化合物和B的某种氢化物反应可生成B的单质,则B、C组成的该化合物所含有的化学键为 ______ 。
、C组成的某种化合物和B的某种氢化物反应可生成B的单质,则B、C组成的该化合物所含有的化学键为 ______ 。
![]() 与B可组成质量比为7:16的三原子分子,该分子释放在空气中其化学作用可能引发的后果有: ______ 。
与B可组成质量比为7:16的三原子分子,该分子释放在空气中其化学作用可能引发的后果有: ______ 。
①酸雨 ②温室效应 ③光化学烟雾 ④臭氧层破坏
![]() 和C组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式是 ______ 。
和C组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式是 ______ 。
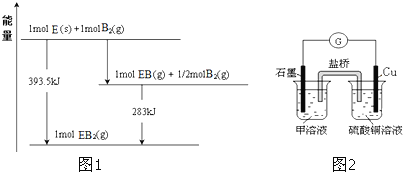
![]() 已知一定量的E单质能在
已知一定量的E单质能在![]()
![]() 中燃烧,其可能的产物及能量关系如图1所示:请写出一定条件下
中燃烧,其可能的产物及能量关系如图1所示:请写出一定条件下![]() 与
与![]() 反应生成
反应生成![]() 的热化学方程式 ______ 。
的热化学方程式 ______ 。
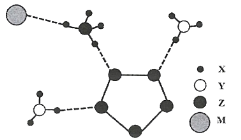
![]() 若在D与F组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如图2所示,其反应中正极出现的现象是 ______ ,负极的反应式为 ______ 。
若在D与F组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如图2所示,其反应中正极出现的现象是 ______ ,负极的反应式为 ______ 。