题目内容
【题目】节能减排措施是我国“十一五”期间提出的政策措施。
(1)煤的燃烧,会产生大量有害气体。将煤转化为水煤气,可有效降低排放。
C(s)+O2(g)=CO2(g) △H=-393.5 kJ·mol-1
H2(g)+ ![]() O2(g)=H2O(g) △H=-242.0kJ·mol-1
O2(g)=H2O(g) △H=-242.0kJ·mol-1
CO(g)+![]() O2(g)=CO2(g) △H=-283.0kJ·mol-1
O2(g)=CO2(g) △H=-283.0kJ·mol-1
根据以上数据,写出C(s)与水蒸气反应生成CO和H2的热化学方程式___________。
(2)汽车尾气的排放是大气污染物的重要来源,其中含有NO气体。根据资料显示用活性炭还原法可以处理氮氧化物,某硏究小组向固定容积的密闭容器中加入一定量的活性炭和NO发生反应C(s)+2NO(g)![]() CO2(g)+N2(g) △H=-574kJ·mol-1,并在温度T时将所测反应数据制成下表:
CO2(g)+N2(g) △H=-574kJ·mol-1,并在温度T时将所测反应数据制成下表:

①0到10min内,NO的平均反应速率v(NO)=___________mol·L-1·min-1。
②下列数据不再变化可表示该反应达到平衡的是___________。
a.容器内压强 b.混合气体的平均摩尔质量 c.混合气体的密度
③若容器改为可变容积容器,达平衡后,再充入少量NO气体,再次达到平衡时N2的浓度 ____________(填“增大”,“减小”,或“不变”)
(3)在某温度T时能同时发生反应:
2N2O5(g)![]() 2N2O4(g)+O2(g) K1
2N2O4(g)+O2(g) K1
N2O4(g)![]() 2NO2(g) K2
2NO2(g) K2
若向一体积固定为2L的密闭容器内加入N2O5 2mol,一段时间后,容器内的反应达到平衡,此时n(NO2)=0.4mol,已知K2=0.1,请计算出K1=___________。
(4)在一定温度下,有a、硫酸氢钠b、硫酸c、醋酸三种溶液,若三者c(H+)相同时,物质的量浓度由大到小的顺序是_____,当三者c(H+)相同且体积也相同时,分别放入足量的锌,相同状况下产生气体的体积由大到小的顺序是___。
【答案】C(s)+H2O(g)=CO(g)+H2(g) △H=+131.5kJ·mol-1 0.048 bc 不变 0.16 c>a>b . c>a=b
【解析】
(1)①C(s)+O2(g)=CO2(g)△H=-393.5 kJmol-1,②H2(g)+![]() O2(g)=H2O(g)△H=-242.0kJmol-1,③CO(g)+
O2(g)=H2O(g)△H=-242.0kJmol-1,③CO(g)+![]() O2(g)=CO2(g)△H=-283.0kJmol-1,根据盖斯定律①-②-③可得;
O2(g)=CO2(g)△H=-283.0kJmol-1,根据盖斯定律①-②-③可得;
(2)①根据v=![]() 计算;
计算;
②根据平衡状态特征分析;
③根据压强对反应的影响可得
(3)一体积固定为2L的密闭容器,容器内的反应达到平衡,此时n(NO2)=0.4mol,c(NO2)=0.2mol/L,已知K2=0.1,则容器中有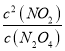 =0.1,可得c(N2O4)=0.4mol/L,根据反应N2O4(g)2NO2(g)得到0.2mol/L的NO2则消耗N2O40.1mol/L,则由反应2N2O5(g)2N2O4(g)+O2(g)生成的N2O4有0.5mol/L,再根据反应解得各物质的浓度,计算K1;
=0.1,可得c(N2O4)=0.4mol/L,根据反应N2O4(g)2NO2(g)得到0.2mol/L的NO2则消耗N2O40.1mol/L,则由反应2N2O5(g)2N2O4(g)+O2(g)生成的N2O4有0.5mol/L,再根据反应解得各物质的浓度,计算K1;
(4)硫酸为二元酸,硫酸氢钠能完全电离出H+,相当于一元强酸,醋酸为弱酸,强酸完全电离,弱酸部分电离;当c(H+)相同、体积相同时,硫酸氢钠、硫酸完全电离,只有醋酸在继续电离;
(1)C(s)+O2(g)=CO2(g)△H=-393.5 kJmol-1,②H2(g)+![]() O2(g)=H2O(g)△H=-242.0kJmol-1,③CO(g)+
O2(g)=H2O(g)△H=-242.0kJmol-1,③CO(g)+![]() O2(g)=CO2(g)△H=-283.0kJmol-1,根据盖斯定律①-②-③可得C(s)+H2O(g)=CO(g)+H2(g))△H=+131.5kJmol-1;
O2(g)=CO2(g)△H=-283.0kJmol-1,根据盖斯定律①-②-③可得C(s)+H2O(g)=CO(g)+H2(g))△H=+131.5kJmol-1;
(2)①0到10min内,NO的平均反应速率v(NO)=![]() =0.048molL-1min-1;
=0.048molL-1min-1;
②a.反应C(s)+2NO(g)CO2(g)+N2(g)是个气体体积不变的反应,容器内压强始终保持不变,故a错误;
b.根据M=![]() ,混合气体的质量增大,n不变,平均摩尔质量增大,混合气体平均摩尔质量不变时达到平衡,故b正确;
,混合气体的质量增大,n不变,平均摩尔质量增大,混合气体平均摩尔质量不变时达到平衡,故b正确;
c.跟ρ=![]() ,混合气体的质量增大,体积不变,混合气体的密度增大,混合气体的密度不变时达到平衡,故c正确;
,混合气体的质量增大,体积不变,混合气体的密度增大,混合气体的密度不变时达到平衡,故c正确;
故答案为bc;
③若容器改为可变容积容器达平衡后改变某一条件,一段时间后,反应再次达到原平衡,因为反应是个气体体积不变的反应,故压强对其平衡无影响,故可以是增加NO浓度;
(3)一体积固定为2L的密闭容器,容器内的反应达到平衡,此时n(NO2)=0.4mol,c(NO2)=0.2mol/L,已知K2=0.1,则容器中有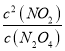 =0.1,可得c(N2O4)=0.4mol/L,根据反应N2O4(g)2NO2(g)得到0.2mol/L的NO2则消耗N2O40.1mol/L,则由反应2N2O5(g)2N2O4(g)+O2(g)生成的N2O4有0.5mol/L,则生成的c(O2)=
=0.1,可得c(N2O4)=0.4mol/L,根据反应N2O4(g)2NO2(g)得到0.2mol/L的NO2则消耗N2O40.1mol/L,则由反应2N2O5(g)2N2O4(g)+O2(g)生成的N2O4有0.5mol/L,则生成的c(O2)=![]() c(N2O4)=0.25mol/L,消耗的c(N2O5)=0.5mol/L,平衡时c(N2O5)=1mol/L-0.5mol/L=0.5mol/L,故K1=
c(N2O4)=0.25mol/L,消耗的c(N2O5)=0.5mol/L,平衡时c(N2O5)=1mol/L-0.5mol/L=0.5mol/L,故K1=![]() =0.16:
=0.16:
(4)硫酸为二元酸,硫酸氢钠能完全电离出H+,相当于一元强酸,醋酸为弱酸,若三者c(H+)相同时,物质的量浓度由大到小的顺序是c>a>b;当c(H+)相同、体积相同时,硫酸氢钠、硫酸完全电离,只有醋酸在继续电离,则分别加入足量锌,相同状况产生的气体体积由大到小的顺序为c>a=b。

【题目】在不同温度下,向 2 L密闭容器中加入1 mol NO(g)和1 mol活性炭(C),发生反应:2NO(g)+C(s) ![]() N2(g)+CO2(g) ΔH=-213.5 kJ·mol-1,达到平衡时的数据如下。
N2(g)+CO2(g) ΔH=-213.5 kJ·mol-1,达到平衡时的数据如下。
温度/℃ | n(C)/mol | n(CO2)/mol |
t1 | 0.70 | |
t2 | 0.25 |
下列说法不正确的是( )
A.上述信息可推知:t1<t2
B.t1℃ 时,该反应的平衡常数K=![]()
C.t2℃ 时,若反应达平衡后再缩小容器的容积,c(N2)∶c(NO)不变
D.t1℃ 时,若开始时反应物的用量均减小一半,平衡后NO的转化率减小