��Ŀ����
����Ŀ��X��Y��Z��W����ԭ������������������ֶ���������Ԫ�ء�����������������������Ԫ�����ڱ��У�Y��Z��W��λ����ͼ��ʾ����Y��Z��W����Ԫ�ص�ԭ������������֮��Ϊ17����X��Y��W�ֱ�λ�ڲ�ͬ���ڡ�����˵����ȷ����
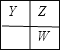
A. ����Ԫ�ص�ԭ�Ӱ뾶��С˳��ΪW>Y>X>Z
B. Z��WԪ�ص�����⻯��ķе�ΪH2Z<H2W
C. X��Y��Z�����γ����ӻ���������γɹ��ۻ�����
D. X�ֱ���Y��Z֮���γɵĺ����������Ϊ10����ֻ��YX3��X2Z
���𰸡�C
������������������Ԫ�صĽṹ���������ڱ��е�λ�ÿ�֪��X��Y��Z��W�ֱ���H��N��O��S��
�����A��ͬ����Ԫ�ش����ң�ԭ�Ӱ뾶��С��ͬ����Ԫ�أ�ԭ�Ӱ뾶��������ԭ�Ӱ뾶˳����r��X����r��Z����r��Y����r��W����A����
B��Z��W�ֱ���O��S��ˮ�������γɵľ��嶼�Ƿ��Ӿ��壬��ˮ�����л�����������Էе�ˮ�ĸߣ���H2Z�ķе��H2W�ߣ�B����
C��X����������Ԫ��֮���γɵĺ����������Ϊ10������NH3��NH4����NH2����H2O��OH����H3O������6�֣�C����
D��X��Y��Z�γɵĻ�������������ǹ��ۻ��������������ӻ����D��ȷ��
��ѡD��

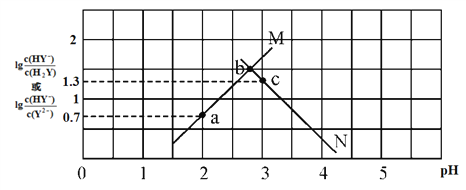
����Ŀ��һ���¶��£����ܵ���ʵı�����Һ�д����ų����ܽ�ƽ�⣬��֪��
���� | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
Ksp(25 ��) | 8.0��10��16 | 2.2��10��20 | 4.0��10��38 |
25 ��ʱ�����ں�Fe2(SO4)3��FeSO4��CuSO4��0.5 mol��1 L�����Һ�������ϱ������жϣ�����˵������ȷ����(����)
A. ��pH��5����Һ�У�Fe3�����ܴ�������
B. �����Һ��c(SO![]() )��[c(Fe3��)��c(Fe2��)��c(Cu2��)]>5��4
)��[c(Fe3��)��c(Fe2��)��c(Cu2��)]>5��4
C. ������Һ����μ���0.1 mol��L��1NaOH��Һ�����ȿ������ɫ����
D. ������Һ�м���������ˮ��������pH��3��4���ˣ��ɻ�ϴ�����CuSO4��Һ
����Ŀ��Ŀǰ����β���е�NO���������¼��ַ�����
��1���������������ϰ�װ��ת������NO��CO�����Ϊ����β���ijɷ֣������������ڴ�ת�����з�����Ӧ��2CO(g)��2NO(g)![]() N2(g)��2CO2(g) ��H ��
N2(g)��2CO2(g) ��H ��
����֪��N2(g)+O2(g)=2NO(g)��H1����180.5kJ��mol��1
C(s)+O2(g)=CO2(g) ��H2����393.5kJ��mol��1
2C(s)+O2(g)=2CO(g)��H3����221kJ��mol��1
���H=______��
��һ����ȤС���ij����������ʱ��β��������������CO��NO�ٷֺ�����ʱ��仯��ͼ1��ʾ��ǰ0��10s �Σ�CO��NO�ٷֺ���û���Ա仯��ԭ����_____________________��ͬʱ��С���ڹ̶��ݻ�Ϊ2L���ܱ�������ͨ��NO��CO��2mol���з�Ӧ��n(CO2)���¶ȣ�T����ѹǿ��P����ʱ�䣨t���ı仯������ͼ2��ʾ��ͼ�е����ߢ��Ӧ��Ӧ�ӿ�ʼ��ƽ��ʱ��CO2��ʾ��ƽ����Ӧ���ʷֱ�Ϊv(��)��v����v���������ߴ�С��ϵΪ______________��


ͼ1 ͼ2
��2������̿Ҳ�����ڴ�������β���е�NO����1L�����ܱ������м���0.1000molNO��2.030mol�������̿������A��B�������壬�ڲ�ͬ�¶��²��ƽ����ϵ�и����ʵ����ʵ����Լ�������ѹǿ���±���
����̿/mol | NO/mol | A/mol | B/mol | P/MPa | |
200�� | 2.000 | 0.0400 | 0.0300 | 0.0300 | 3.93 |
X | 2.005 | 0.0500 | 0.0250 | 0.250 | 4.56 |
�����ϱ����ݣ�д�������з�����Ӧ�Ļ�ѧ����ʽ____�����ж�X_____200�棨�á���������������=����գ������㷴Ӧ��ϵ��200��ʱ��ƽ�ⳣ��Kp =_____����ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�������������
��3���ü�ӵ绯ѧ����ȥNO�Ĺ��̣���ͼ��ʾ����֪���ص�����������Һ��pH��4~7֮�䣬B��Ϊ_________(���������������)��д��A���ĵ缫��Ӧʽ��____________��