题目内容
【题目】二甲醚制备两种方法原理如下
第一种方法:丹麦Topspe工艺的合成气一步法,是专门针对天然气原料开发的一项新技术。
①2CH4(g)+O2(g)![]() CH3OCH3(g)+H2O(g) △H1
CH3OCH3(g)+H2O(g) △H1
第二种方法:二甲醚生产二步法,即先合成甲醇,甲醇在催化剂下制二甲醚。
②CO(g)+2H2(g)![]() CH3OH(g) △H2
CH3OH(g) △H2
③2CH3OH(g)![]() CH3OCH3 (g)+H2O(g) △H3
CH3OCH3 (g)+H2O(g) △H3
(1)若由合成气(CO、H2)直接制备 1molCH3OCH3(g),且生成H2O(1),整个过程中放出的热量为244kJ,则△H2=___________kJ·mol-1。(已知:H2O(1)=H2O(g) △H=+44.0 kJ/mol)
(2)下列有关反应①叙述不正确的是___________
a.达到平衡后,升高温度,ν正减少、ν逆增大,平衡逆向移动
b.当四种物质的浓度相等,反应达到化学平衡状态
c.若改变条件,反应物的转化率一定增大,正反应速率一定大于逆反应速率
d.当达到平衡时2v正(O2)=v逆(CH4)
e.向该恒容平衡体系中充入氩气,ν正、ν逆均增大,平衡向右移动
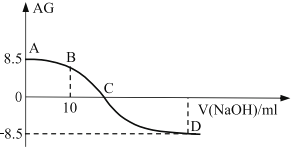
(3)有人模拟制备原理Ⅱ,绘制如图甲图像:
i说明CO的转化率随温度升高先增大后减小的原因:______________________。
ii.反应②自发进行的条件是______________________。
iii.若在350℃时的2L的密闭容器中充入2 mol CO和6molH2,8min达到平衡,c(CH3OCH3)=0.3mol·L-1,用H2表示反应②的速率是___________;可逆反应③的平衡常数K3=___________。
iv.若350℃时测得容器中n(CH3OH)=n(CH3OCH3),此时反应③v(正)___________ν(逆),说明原因_________。
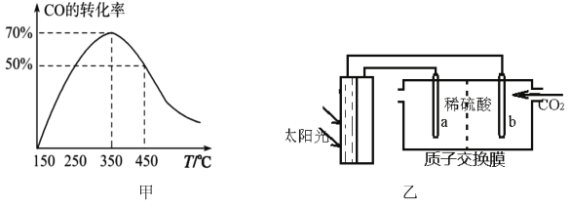
(4)光能储存一般是指将光能转换为电能或化学能进行储存,利用太阳光、CO2、H2O生成二甲醚的光能储存装置如图乙所示则b极的电极反应式为___________________________。
【答案】(-100-0.5△H3)kJ mol-1 a b c e 低于350℃时,反应未达平衡,温度越高,CO转化率越高。高于350℃时,反应均已达平衡,温度越高,平衡逆向移动CO转化率越低。 低温下自发 0.175mol/(L·min) 9 > 此时Q=1<9=K,说明反应还未达到平衡,需正向移动。 12H++2CO2+12e-==CH3OCH3+3H2O
【解析】
(1) 利用盖斯定律就可以求出△H
iii利用三等式,可求解。
(1)利用盖斯定律合成气(CO、H2)直接制备 1molCH3OCH3(g)的反应2CO(g)+4H2(g)= CH3OCH3 (g)+H2O(g),其反应热等于2×△H2+△H3 -△H=-244kJ/mol,则△H2=-100-0.5△H3 kJ mol-1 答案为-100-0.5△H3;
(2) a. 升高温度, 不管是正反应速率,还是逆反应速率都会增加,a符合题意;b. 平衡状态时,只要求各物质浓度保持不变,不要求相等,b符合题意;c. 改变条件,比如扩大体积,平衡,逆向移动反应物的转化率减小, c符合题意;d.当达到平衡时,正反应速率等于逆反应速率且成比例,d不符合题意;e.向该恒容平衡体系中充入氩气,各反应物和生成物的浓度不变,化学反应速率不变;e符合题意,答案为abce;
(3) i根据图像前部分,温度不高,反应没有达到平衡,反应还在向正向移动,转化率增加;后一部分,温度较高,反应达到平衡,升高温度,平衡逆向移动,转化率降低。答案为低于350℃时,反应未达平衡,温度越高,CO转化率越高。高于350℃时,反应均已达平衡,温度越高,平衡逆向移动CO转化率越低;
ii从反应②可以看出来,反应熵减小的反应,根据△G=△H-T△S,反应要自发,应该在低温下进行;答案为低温下自发;
iii350℃下,CO的转化率70%,CO消耗1.4mol,则H2消耗2.8mol,![]() 答案为0.175 mol/(L·min),生成
答案为0.175 mol/(L·min),生成
CH3OH为1.4mol,浓度为0.7mol/L。求③的平衡常数利用三等式,
2CH3OH(g) ![]() CH3OCH3 (g) + H2O(g)
CH3OCH3 (g) + H2O(g)
开始的浓度 0.7 mol·L-1 0 0
转化的浓度 0.6mol·L-1 0.3mol·L-1 0.3mol·L-1
平衡的浓度 0.1mol·L-1 0.3mol·L-1 0.3mol·L-1
![]() ,答案为0.175 mol/(L·min) 9;
,答案为0.175 mol/(L·min) 9;
iv.根据浓度商计算,n(CH3OH)=n(CH3OCH3)=n(H2),![]() ,正向移动, v(正)>ν(逆),答案为>,n(CH3OH)=n(CH3OCH3)=n(H2),
,正向移动, v(正)>ν(逆),答案为>,n(CH3OH)=n(CH3OCH3)=n(H2),![]() ,反应正向移动;
,反应正向移动;
(4) 根据电荷守恒和物料守恒,写出来,答案为12H++2CO2+12e-==CH3OCH3+3H2O。

【题目】印刷电路板是由有机复合材料和铜箔复合构成,刻制印刷电路时,要用FeCl3溶液作为“腐蚀液”,研究其制备及性质是一个重要的课题。
(1)氯化铁晶体的制备(夹持及加热装置省略)
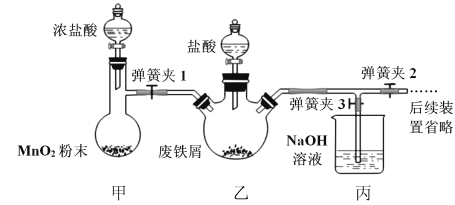
①实验过程中装置甲中发生反应的离子方程式_________________________________。
②为顺利达成实验目的,上述装置中甲中活塞、乙中活塞、弹簧夹1、2、3打开和关闭的顺序为__________。
③反应结束后,将乙中溶液边加入___________,边进行加热浓缩、___________、过滤、洗涤、干燥即得到产品。
(2)氯化铁的性质探究:
已知:①氯化铁的熔点为306℃、沸点为315℃,易升华,气态FeCl3会分解成FeCl2和Cl2②FeCl2熔点670℃)

操作步骤 | 实验现象 | 解释原因 |
打开K,充入氮气 | D中有气泡产生 | ①充入N2的原因___________ |
关闭K,加热至600℃,充分灼烧固体 | B中出现棕黄色固体 | ②产生现象的原因___________。 |
实验结束,振荡C静置 | ③___________ | ④___________(用方程式解释) |