题目内容
【题目】我国早期科技丛书《物理小识·金石类》写到:“青矾厂气熏人,衣服当之易烂,载木不盛,惟乌柏树不畏其气”,“青矾”则是绿矾,强热时发生如下反应:
2FeSO4·7H2O→Fe2O3+SO3+SO2+7H2O
回答下列问题:
(1)基态硫原子的价层电子排布式___________,其最高能级上电子云形状是___________,上述四种元素电负性由大到小的顺序是___________,从结构的角度解释Fe3+稳定性强于Fe2+的原因是__________。
(2)氧、硫能形成许多化合物,如:H2O、SO2、SO3、SO42-,这些物质的中心原子杂化轨道类型为SP2的是___________,空间构型是V形的分子是___________,属于非极性分子的是___________。
(3)已知Fe2O3熔点为1565℃,在熔化状态下液体中存在两种粒子,则其晶体类型最可能是___________,若FeO与Fe2O3晶体类型相同,则二者熔点较高的物质是___________。
(4)铁的某种氧化物晶胞如图所示(实心球为铁原子);
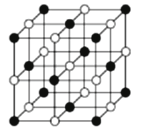
①该氧化物的化学式为___________。
②氧、铁的原子半径分别为rO pm、rFe pm,晶体密度为ρg·cm-3,阿伏伽德罗常数的值为NA,该晶胞的空间利用率为___________(用含π的式子表示)
【答案】3s23p4 纺锤形 Fe<H<S<O Fe3+的3d能级为3d5,处于半充满状态,较稳定。 SO2、SO3 H2O、SO2 SO3 离子晶体 Fe2O3 FeO ![]()
【解析】
(1) 根据核外电子排布规律可以写出,半充满或全充满比较稳定;
(2) ABm型杂化类型的判断;中心原子电子对数n=![]() (中心原子价电子数+配位原子成键电子数±加减电荷数),通过n就可知杂化轨道数,价层电子对互斥理论(VSEPR)分析构型;
(中心原子价电子数+配位原子成键电子数±加减电荷数),通过n就可知杂化轨道数,价层电子对互斥理论(VSEPR)分析构型;
(3)离子化合物在熔融状态下能够电离;
(1) 硫为第三周期,第ⅥA族的元素,价电子有6个,价层电子排布为3s23p4,能级最高的轨道为p轨道,为纺锤形,四种元素分别为Fe、H、S、O,根据元素周期律可以得到其电负性排序为Fe<H<S<O,Fe3+的3d能级为3d5,处于半满状态,而Fe2+的3d能级为3d6,答案为3s23p4 纺锤形 Fe<H<S<O Fe3+的3d能级为3d5处于半充满状态,较稳定;
(2) H2O中O原子杂化轨道数![]() ,为sp3,SO2中的S原子杂化轨道数
,为sp3,SO2中的S原子杂化轨道数![]() ,为sp2杂化,SO3中的S原子杂化轨道数
,为sp2杂化,SO3中的S原子杂化轨道数![]() ,为sp2杂化,SO42-中的S原子杂化轨道数
,为sp2杂化,SO42-中的S原子杂化轨道数![]() ,为sp3杂化,为sp2有SO2和SO3,其中V
,为sp3杂化,为sp2有SO2和SO3,其中V
形的分子有H2O和SO2,利用价层电子对互斥理论(VSEPR)分析构型H2O价层电子对个数![]() ,为V形分子,同理SO2V形分子,SO3为平面三角形分子,SO42-为正四面体构型,SO3为平面三角形分子,非极性分子。答案为SO2、SO3 H2O和SO2 SO3;
,为V形分子,同理SO2V形分子,SO3为平面三角形分子,SO42-为正四面体构型,SO3为平面三角形分子,非极性分子。答案为SO2、SO3 H2O和SO2 SO3;
(3) 离子晶体在高温下会发生电离,产生阴阳离子,其晶体类型最可能是离子晶体;Fe2O3中Fe3+所带电荷较高,离子键较强,熔点高;答案为离子晶体 Fe2O3;
(4) 从晶胞可以看出,阴阳离子个数比为1:1,所以化学式为FeO, 空间利用率=元素所占的体积/晶胞的体积,晶胞中有4个O原子和4个Fe原子,则原子的所占的体积为![]() ,根据
,根据![]() ,求出体积,
,求出体积,![]() ,利用率为
,利用率为![]() ,答案FeO
,答案FeO ![]() 。
。