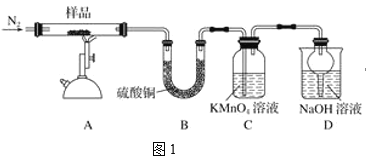
题目内容
【题目】化学上常用AG表示溶液中的酸碱度,AG=![]() 。25℃时,用0.100mol/L的NaOH溶液滴定20.00m 0.100mol/L的醋酸溶液,AG与所加NaOH溶液的体积(V)关系如图所示,下列说法错误的是:
。25℃时,用0.100mol/L的NaOH溶液滴定20.00m 0.100mol/L的醋酸溶液,AG与所加NaOH溶液的体积(V)关系如图所示,下列说法错误的是:
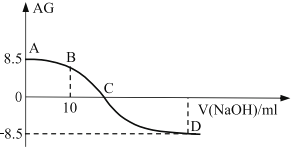
A. 点C时溶液存在c(Na+)=c(CH3COO-)>c(OH-)=c(H+)
B. 点B时溶液存在2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH)
C. 25℃时,醋酸的水解常数Kh=10-4.5
D. 点D溶液的pH=11.25
【答案】C
【解析】
A.C点AG=0,说明![]() ,溶液呈现中性,溶液中之后4种离子,电荷守恒为c(Na+) +c(H+)=c(OH-) +c(CH3COO-),中性c(H+)=c(OH-),则c(Na+)=c(CH3COO-),且c(Na+)> c(H+),c(Na+)=c(CH3COO-)>c(OH-)=c(H+)正确,A不符合题意;
,溶液呈现中性,溶液中之后4种离子,电荷守恒为c(Na+) +c(H+)=c(OH-) +c(CH3COO-),中性c(H+)=c(OH-),则c(Na+)=c(CH3COO-),且c(Na+)> c(H+),c(Na+)=c(CH3COO-)>c(OH-)=c(H+)正确,A不符合题意;
B.加入10mLNaOH,与醋酸反应。醋酸恰好消耗一半,得到的溶液为为等物质的量的CH3COOH和CH3COONa的混合溶液。电荷守恒为c(Na+) +c(H+)=c(OH-) +c(CH3COO-),物料守恒为2c(Na+) = c(CH3COO-)+ c(CH3COOH),将两式联合,可以得到2c(H+)+ c(CH3COOH)=2c(OH-) +c(CH3COO-),移项可得2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH),B项不符合题意;
C.根据题干信息,AG=![]() ,滴定没有开始时,AG=8.5,而且根据25℃时,溶液中
,滴定没有开始时,AG=8.5,而且根据25℃时,溶液中![]() ,可知开始时c(H+)=10-2.75,
,可知开始时c(H+)=10-2.75,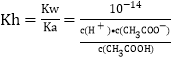 ,可以近似认为c(H+)= c(CH3COO-),c(CH3COOH)基本不变。
,可以近似认为c(H+)= c(CH3COO-),c(CH3COOH)基本不变。 ,不是Kh=10-4.5,C项符合题意;
,不是Kh=10-4.5,C项符合题意;
D.根据题干信息,AG=![]() ,D点AG=-8.5,而且根据25℃时,溶液中
,D点AG=-8.5,而且根据25℃时,溶液中![]() ,可求出c(H+)=10-11.25,D溶液的pH=11.25,D项不符合要求。
,可求出c(H+)=10-11.25,D溶液的pH=11.25,D项不符合要求。
本题答案选C。

【题目】某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中P表示压强,T表示温度,n表示物质的量):
|
|
|
|
根据以上规律判断,下列结论正确的是( )
A. 反应Ⅰ:ΔH>0,P2>P1 B. 反应Ⅱ:ΔH<0,T1<T2
C. 反应Ⅲ:ΔH>0,T2>T1;或ΔH<0,T2<T1 D. 反应Ⅳ:ΔH<0,T2>T1