题目内容
【题目】下列溶液的物质的量浓度的计算正确的是![]()
![]()
A. VL![]() 溶液中含
溶液中含![]() g,溶液中
g,溶液中![]() 是
是![]()
![]()
B. 将100mL![]()
![]() 的NaCl溶液与200mL
的NaCl溶液与200mL![]()
![]() 的NaCl溶液混合
的NaCl溶液混合![]() 忽略溶液体积变化
忽略溶液体积变化![]() ,得到溶液的物质的量浓度为2
,得到溶液的物质的量浓度为2![]()
C. 实验室配制480mL![]()
![]() 的硫酸铜溶液,应选取500mL容量瓶,称取
的硫酸铜溶液,应选取500mL容量瓶,称取![]() g胆矾配成500mL溶液
g胆矾配成500mL溶液
D. 标准状况下,aL![]() 溶于1000g水中,得到的溶液密度为b
溶于1000g水中,得到的溶液密度为b![]() ,则该溶液的物质的量浓度为
,则该溶液的物质的量浓度为![]()
![]()
【答案】C
【解析】根据cB=![]() 计算物质的量浓度和相关物理量。
计算物质的量浓度和相关物理量。
A项,n(Fe3+)=![]() =
=![]() mol,n(Fe3+):n(SO42-)=2:3,n(SO42-)=
mol,n(Fe3+):n(SO42-)=2:3,n(SO42-)=![]() mol,溶液中c(SO42-)=
mol,溶液中c(SO42-)=![]() mol
mol![]() VL=
VL=![]() mol/L,A项错误;B项,混合后所得溶液物质的量浓度为
mol/L,A项错误;B项,混合后所得溶液物质的量浓度为![]() =2.17mol/L,B项错误;C项,根据“大而近”的原则,配制480mL溶液应选用500mL容量瓶,所需胆矾的质量为0.1mol/L
=2.17mol/L,B项错误;C项,根据“大而近”的原则,配制480mL溶液应选用500mL容量瓶,所需胆矾的质量为0.1mol/L![]() 0.5L
0.5L![]() 250g/mol=12.5g,C项正确;D项,n(NH3)=
250g/mol=12.5g,C项正确;D项,n(NH3)=![]() mol,m(溶液)=m(NH3)+m(H2O)=
mol,m(溶液)=m(NH3)+m(H2O)=![]() mol
mol![]() 17g/mol+1000g=(
17g/mol+1000g=(![]() +1000)g,溶液的体积为(
+1000)g,溶液的体积为(![]() +1000)g
+1000)g![]() bg/cm3=
bg/cm3=![]() cm3,溶液物质的量浓度为
cm3,溶液物质的量浓度为![]() mol
mol![]() (
(![]() 10-3)L=
10-3)L=![]() mol/L,D项错误;答案选C。
mol/L,D项错误;答案选C。

 名校课堂系列答案
名校课堂系列答案【题目】硫代硫酸钠是一种重要的化工产品。某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3·5H2O)。查阅资料知:
①Na2S2O3·5H2O是无色透明晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成。
②向Na2CO3和Na2S混合溶液中通入SO2可制得Na2S2O3。
③BaSO3难溶于水,可溶于稀HCl。
实验装置如图所示(省略夹持装置)
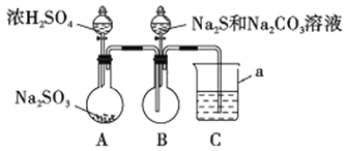
(1)仪器a的名称是_________;C中的试剂可以是______ (选填下列字母编号)。
A.稀H2SO4 B.酸性KMnO4溶液 C.饱和NaHSO3溶液 D.NaOH溶液
(2)此实验装置设计有缺陷,其改进方法是_________________________。
(3)写出B中反应的离子方程式_________________________________________。
(4)A、B中反应完后,在拆装置前,应将其中污染空气的有毒气体除去,采用的方法和具体操作是________________________________________。
(5)该法所得产品中常含有少量Na2SO3和Na2SO4。为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。(所需试剂从稀HNO3、稀H2SO4、稀HCl、蒸馏水中选择)
取适量产品配成稀溶液,加足量BaCl2溶液,有白色沉淀生成,_______________,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。
(6)测定产品纯度:准确称取Wg产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.1000mol/L碘的标准溶液滴定。(反应原理为:2S2O32-+I2=S4O62-+2I-)
①滴定至终点时,溶液颜色的变化是_______________________。
②滴定记录数据如下表:
滴定前读数/mL | 滴定后读数/mL | |
第一次 | 0.10 | 16.12 |
第二次 | 1.10 | 17.08 |
第三次 | 1.45 | 19.45 |
第四次 | 0.00 | 16.00 |
③产品的纯度为(设Na2S2O3·5H2O相对分子质量为M)______________。