题目内容
【题目】合成气的主要成分是 一氧化碳和氢气,是重要的化工原料。
I.已知下列反应:
①CH4(g) + H2O(g)![]() CO(g) + 3H2(g) ΔH = +206 kJ/mol
CO(g) + 3H2(g) ΔH = +206 kJ/mol
②C(s) + H2O(g) = CO(g) + H2(g) ΔH = +131 kJ/mol
(1)工业制取炭黑的方法之一是将甲烷隔绝空气加热到1300℃进行裂解。填写空白。
CH4(g)= C(s)+ 2H2(g) ΔH =______________kJ/mol。
(2)若800℃时,反应①的平衡常数K1=1.0,某时刻测得该温度下,密闭容器中各物质的物质的量浓度分别为:c(CH4)=4.0 mol·L-1;c(H2O)=5.0 mol·L-1;c(CO)=1.5 mol·L-1;c(H2)=2 mol·L-1,则此时该可逆反应的状态是_____________________(填“达到平衡”、“向正反应方向移动”或“向逆反应方向移动”)。
Ⅱ.甲醇是一种可再生能源,工业上用合成气来合成甲醇:CO(g)+2H2(g)![]() CH3OH(g),分析该反应并回答下列问题:
CH3OH(g),分析该反应并回答下列问题:
(3)一定条件下,将CO与H2以物质的量之比1:1置于恒容密闭容器中发生以上反应,能说明该反应已达到平衡的是_____________________________。
A.体系的压强不发生变化 B.混合气的密度保持不变
C.体系中碳元素的质量分数不变 D.CO与H2的物质的量之比保持不变
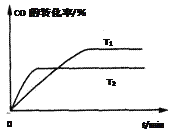
(4)如图是该反应在不同温度下CO的转化率随时间变化的曲线。T1和T2温度下的平衡常数大小关系是K1______K2 (填“>”、“<”或“=”)。理由是__________________________________________________。
(5)已知甲醇燃料电池的工作原理如图所示。该电池工作时,电池左边的电极发生的电极反应式为______________________________。
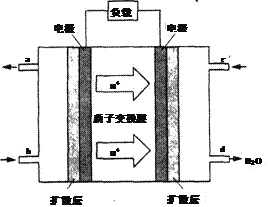
(6)用甲醇燃料电池作为直流电源,设计如图装置制取Cu2O,电解总反应为:2Cu+H2O=Cu2O+H2↑。写出铜电极的电极反应式_______________________。

【答案】 +75 向正反应方向移动 AD > 由图可知温度由T1升高至T2时,CO的转化率降低,说明平衡向逆反应方向移动,所以K1>K2 2CH3OH-12e-+2H2O=2CO2+12H+ 或CH3OH-6e-+H2O=CO2+6H+ 2Cu+2OH--2e-=Cu2O+H2O
【解析】(1)已知:
①CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH=+206 kJ/mol
CO(g)+3H2(g) ΔH=+206 kJ/mol
②C(s)+H2O(g)=CO(g)+H2(g) ΔH=+131 kJ/mol
根据盖斯定律可知①-②即得到CH4(g)=C(s)+2H2(g)的ΔH=+75kJ/mol。
(2)此时浓度熵为![]() <1,所以向正反应方向移动;(3)A.正反应体积减小,则体系的压强不发生变化可以说明达到平衡状态,A正确;B.混合气的质量和容器容积始终不变,则密度始终不变,不能说明,B错误;C.根据质量守恒定律可知体系中碳元素的质量分数始终不变,不能说明,C错误;D.由于CO与H2的物质的量之比不是按照化学计量数之比通入的,则CO与H2的物质的量之比保持不变时,可以说明反应达到平衡状态,D正确,答案选AD;(4)首先达到平衡时温度高,由图可知温度由T1升高至T2时,CO的转化率降低,说明平衡向逆反应方向移动,所以K1>K2。(5)氢离子向右侧移动,则右侧是正极,左侧是负极,甲醇失去电子,电极反应式为CH3OH-6e-+H2O=CO2+6H+;(6)铜元素化合价升高,失去电子,铜电极是阳极,溶液显碱性,则阳极电极反应式为2Cu+2OH--2e-=Cu2O+H2O。
<1,所以向正反应方向移动;(3)A.正反应体积减小,则体系的压强不发生变化可以说明达到平衡状态,A正确;B.混合气的质量和容器容积始终不变,则密度始终不变,不能说明,B错误;C.根据质量守恒定律可知体系中碳元素的质量分数始终不变,不能说明,C错误;D.由于CO与H2的物质的量之比不是按照化学计量数之比通入的,则CO与H2的物质的量之比保持不变时,可以说明反应达到平衡状态,D正确,答案选AD;(4)首先达到平衡时温度高,由图可知温度由T1升高至T2时,CO的转化率降低,说明平衡向逆反应方向移动,所以K1>K2。(5)氢离子向右侧移动,则右侧是正极,左侧是负极,甲醇失去电子,电极反应式为CH3OH-6e-+H2O=CO2+6H+;(6)铜元素化合价升高,失去电子,铜电极是阳极,溶液显碱性,则阳极电极反应式为2Cu+2OH--2e-=Cu2O+H2O。