题目内容
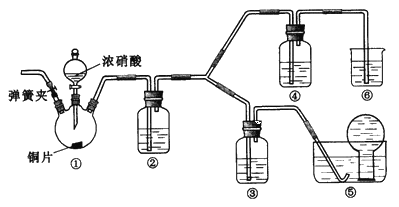
【题目】某学习小组探究浓、稀硝酸氧化性的相对强弱,按下图装置进行实验(夹持仪器已略去)。实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
可选药品:浓硝酸、3mol/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳
已知:氢氧化钠溶液不与NO反应,能与NO2反应:2NO2+2NaOH=NaNO3+NaNO2+H,2O
(1)装置①中发生反应的离子方程式是_______________________________________________________;
(2)装置②的目的是____________________,发生反应的化学方程式是____________________________________;
(3)实验应避免有害气体排放到空气中,装置③、④、⑥中盛放的药品依次是____________;
(4)实验的具体操作是:先检验装置的气密性,再加入药品,然后____________________,__________________
(此操作的目的是_______________________________________________),最后滴加浓硝酸;
(5)该小组得出的结论所依据的实验现象是________________________________________________________。
【答案】 Cu + 4H+ + 2NO3-(浓) = Cu2++ 2NO2↑+ 2H2O 将NO2转化为NO(2分) 3NO2+ H2O = 2HNO3+ NO 3 mol/L稀硝酸 浓硝酸 氢氧化钠溶液 打开弹簧夹通入CO2一段时间,关闭弹簧夹,将装置⑤中导管末端伸入倒置的烧瓶内 赶走装置中空气(氧气) 装置③中液面上方气体仍为无色,装置④中液面上方气体由无色变为红棕色
【解析】验证浓硝酸的氧化性,应首先检查装置的气密性,硝酸与铜发生反应生成二氧化氮,通入水后生成一氧化氮,然后通过浓硝酸,如无色气体生成红棕色气体,可证明硝酸具有氧化性,可氧化一氧化氮,生成的气体不能直接排放到空气中,应有尾气处理装置,据此分析判断。
(1)装置①是铜和浓硝酸反应,其中发生反应的离子方程式为Cu + 4H+ + 2NO3-(浓) = Cu2++ 2NO2↑+ 2H2O;(2)装置①中反应生成了二氧化氮,在装置②中二氧化氮会与水反应,即3NO2+H2O=2HNO3+NO,所以装置②的作用是将NO2转化为NO;(3)根据装置特点和实验目的,装置⑤是收集NO,装置⑥中盛放NaOH溶液吸收NO2防止污染大气;因为要验证稀HNO3不能氧化NO,所以装置③中应该盛放稀硝酸,中盛放浓硝酸;(4)由于装置中残存的空气,能氧化NO而对实验产生干扰,所以滴加浓HNO3之前需要通入一段时间CO2赶走装置中的空气,则实验的具体操作是:先检验装置的气密性,再加入药品,然后打开弹簧夹通入CO2一段时间,关闭弹簧夹,将装置⑤中导管末端伸入倒置的烧瓶内,最后滴加浓硝酸;(5)NO通过稀HNO3溶液后,若无红棕色NO2产生,说明稀HNO3不能氧化NO,所以盛放稀HNO3装置的液面上方没有颜色变化即可说明,装置④中盛放的是浓HNO3,若浓HNO3能氧化NO则装置④液面的上方会产生红棕色气体。

 备战中考寒假系列答案
备战中考寒假系列答案