题目内容
【题目】I.工业上有一种用CO2来生产甲醇燃料的方法:
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1
CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1
将6 mol CO2和8 mol H2充入2 L的密闭容器中,测得H2的物质的量随时间变化如下图所示(实线)。图中数据a(1,6)表示:在1 min时H2的物质的量是6 mol。
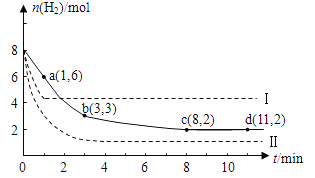
(1)a点正反应速率 (填“大于”“等于”或“小于”)逆反应速率。计算其化学平衡常数K=
(2)下列时间段平均反应速率最大的是
A.O~1 min B.1~3 min C.3~8 min D.8~11 min
(3)仅改变某一实验条件再进行两次实验测得H2的物质的量随时间变化如图中虚线所示。曲线I对应的实验条件改变是 ,曲线Ⅱ对应的实验条件改变是 。
(4)锰酸锂、钛酸锂都是绿色环保新型能源材料,可以用MnO2为原料制取锰酸锂。
①以石墨为电极,电解酸化的MnSO4溶液可制备MnO2,则阳极的电极反应式为 。
②MnO2是碱性锌锰电池的正极材料.碱性锌锰电池放电时,正极的电极反应式为 。
【答案】(1)大于(1分)K=0.5L2/mol2 (2)A(3)升温 增大压强或增大CO2 浓度
(4)①Mn2++2H2O﹣2e﹣=MnO2+4H+ ②MnO2+H2O+e﹣=MnO(OH)+OH﹣
【解析】
试题分析:Ⅰ(1)a点氢气的物质的量还是在减小的,所以反应是在向正反应方向进行,因此正反应速率大于逆反应速率。平衡时氢气是2mol,则消耗氢气是6mol,所以同时消耗CO2是2mol,生成甲醇和水蒸气是2mol。所以平衡常数等于![]() 。
。
(2)反应速率越大,反映在曲线上斜率就越大,所以反应速率最大的是0~1 min,即A是正确的。
(3)根据图像可知曲线I对应的反应速率快,平衡时氢气的物质的量大,说明平衡是向逆反应方向移动的,因此改变的条件是升高温度。曲线Ⅱ的反应速率也快,但平衡时氢气的物质的量小,说明向正反应方向移动,因此是增大压强或增大CO2 浓度。
Ⅱ.(4)①阳极失去电子,则阳极应该是锰离子失去电子转化为二氧化锰,电极反应式为Mn2++2H2O﹣2e﹣=MnO2+4H+;②碱性锌锰电池放电时,正极是二氧化锰得到电子,其电极反应式为MnO2+H2O+e﹣=MnO(OH)+OH﹣。